Оглавление:



Водородная связь
- Водородная связь. Промежуточные символы между интер По молекулярным взаимодействиям и ковалентным связям Родная связь. Это происходит при положительной поляризации Атом водорода и отрицательно поляризованный атом Высокая электроотрицательность, например, атом фтора, кислоты Загрузчик или азот.
- Положительно поляризованный атом водорода Очень маленький размер и Потому что нет внутреннего электронного слоя. Проникающая электронная оболочка имеет отрицательную поляризацию Соседняя молекула атома. Условная водородная связь X — H — Написать как Y. Где X и V представляют собой P, L, O или 5 атомов (точно Сама водородная связь указана).
Между двумя молекулами в суете Взаимодействие электростатическое и отчасти Но природа донора-акцептора. Людмила Фирмаль
Рассмотрим возникновение водородных связей во взаимодействиях. Две молекулы фтористого водорода. Внутримолекулярные ГП электроны Пара заменена атомом фтора, то есть атом водорода поляризован Фургон положительный, а атом фтора отрицательный. Интер поло Одна молекула положительно поляризованного атома водорода НР И отрицательно поляризованный атом фтора второй молекулы Происходит водородная связь к-п.
Каждый атом водорода полученного димера связан с двумя Атом фтора с одной ковалентной связью и одним водородом Связь. Энергия и длина водородной связи в значительной степени определяется Делится на электрический момент и размеры диполя связи Atom. Длина связи укорачивается, энергия водородной связи При увеличении разницы в электронной плотности между атомами X и Y, соответственно, Электрический момент и уменьшение X — H диполей связи В зависимости от размера атома U.
Например, с молекулами воды Разница между EO кислорода и водорода составляет 0,5, длина связи триа de O — H — 0 равен 0,096 нм для O-H и 0,204 нм для H — 0, Энергия водородной связи H — 0 составляет 21,51 кДж / моль. ОО В случае молекулы НН с одинаковой разницей между фтором и водородом 1.9, длина связи PH и H — P одинаковая, равна 0,113 нм, энергия Водородная связь Н – Р составляет 113 кДж / моль.
- Мерима с энергией ковалентной связи. Обычно энергия водородной связи составляет 5 ~ 25 кДж / моль, то есть больше, чем межмолекулярная энергия. Действие, но гораздо меньше ковалентной энергии. Водородная связь очень широко распространена. Она Содержится в неорганических и органических соединениях.
Воды Нативные связи иногда определяют структуру материи и являются заметными Влияет на физико-химические свойства. Играть важную роль Водородная связь в процессах кристаллизации и растворения. Вещество, образование кристаллогидратов, молекулярная ассоциация.
Примером материала, связанного с полимером, является фтор. Людмила Фирмаль
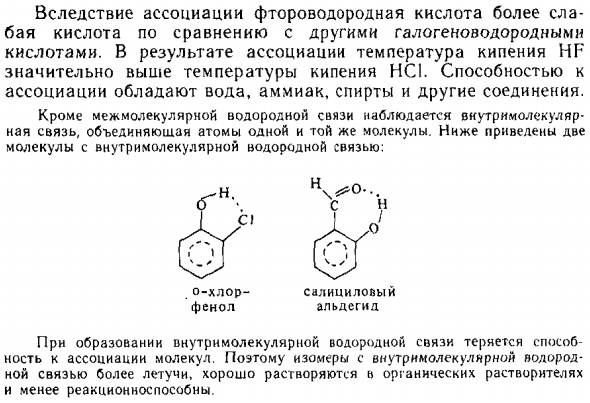
Водород: r r r ‘r r Для ассоциации плавиковая кислота является слабой Соляная кислота по сравнению с другими галогеноводородами Acid. Соответствующая точка кипения H F Это значительно выше, чем температура кипения НС1. мощность Ассоциация владеет водой, аммиаком, спиртом и другими соединениями.
В дополнение к межмолекулярной водородной связи, Intramol <; Основная связь, соединяющая атомы одной молекулы. Ниже два Молекулы с внутримолекулярными водородными связями: (Г-н Н. Cj о- хлор фенол Салициловая кислота альдегид Этот метод теряется при образовании внутримолекулярных водородных связей. Ассоциация с молекулами. Следовательно, изомеры, содержащие внутримолекулярный водород Более летучий, растворимый в органических растворителях Не очень сильно отвечает.
Смотрите также:
| Взаимодействие между молекулами | Донорно-акцепторное взаимодействие молекул |
| Вандерваальсовы силы | Свойства веществ в различных состояниях |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.

