Оглавление:

| Здравствуйте! Я Людмила Анатольевна Фирмаль, занимаюсь помощью студентам более 17 лет. У меня своя команда грамотных, сильных преподавателей. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И неважно – она по объёму на две формулы или огромная, сложно структурированная, на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте. |
| Если что-то непонятно — вы всегда можете написать мне в WhatsApp и я вам помогу! |
Как получить помощь в выполнении заданий по химии
Вы можете написать сообщение в WhatsApp. После этого я оценю ваш заказ и укажу стоимость и срок выполнения вашей работы. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за вашу работу, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл готовой работы в личные сообщения.
Сколько стоит помощь
Стоимость помощи зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости, загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения
Минимальный срок выполнения составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить
Сначала пришлите задание, я оценю, после вышлю вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Гарантии и исправление ошибок
В течение 1 года с момента получения Вами готового решения действует гарантия. В течении 1 года я и моя команда исправим любые ошибки.
Чуть ниже я предоставила примеры оформления работ по химии, так я буду оформлять ваши работы если закажите у меня.
Кроме примеров, я разместила и теорию, если вдруг вы захотите попробовать сами решить, это не все темы, а лишь маленькая и самая сложная часть химии, но я смогу вам помочь с любой темой, поэтому обращайтесь даже с самой простенькой задачкой.
Сначала идёт теория, а потом идут оформленные примеры решения.
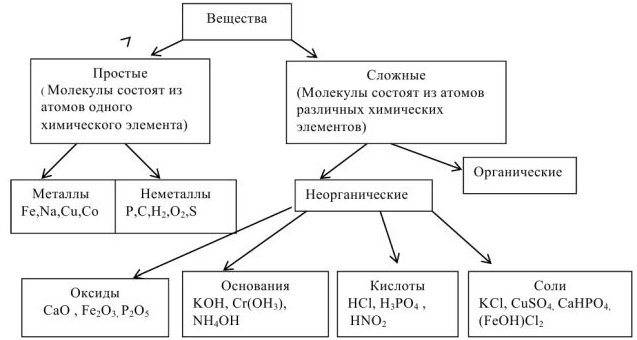
Основные классы неорганических соединений
Химия занимается изучением превращений химических веществ (число известных к настоящему времени веществ более десяти миллионов), поэтому очень важна классификация химических соединений. Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. С проблемой классификации тесно связана проблема номенклатуры, т.с. системы названий этих веществ. Классификация неорганических веществ и их номенклатура основаны на наиболее простой и постоянной характеристике — химическом составе, показывающем качественные и количественные соотношения атомов в соединении.
Классификация основных классов химических соединений.
Для характеристики состояния элементов в соединениях введено понятие степени окисления. Под степенью окисления (С.О.) понимается предполагаемый заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов. Степень окисления может быть положительной, отрицательной ( 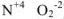 ), дробной величиной (
), дробной величиной ( 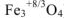 ) или равной нулю (Р°). Для большинства элементов А — подгрупп высшая степень окисления
) или равной нулю (Р°). Для большинства элементов А — подгрупп высшая степень окисления 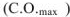 равна номеру группы, а низшая степень окисления равна разности
равна номеру группы, а низшая степень окисления равна разности 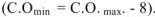 .
.
Например, для S, находящейся в 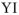 группе ПС
группе ПС 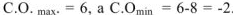 . Все остальные степени окисления элемента называют промежуточными:
. Все остальные степени окисления элемента называют промежуточными: 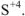 .
.
Высшая положительная степень окисления проявляется, когда в образовании связи принимают участие все валентные электроны атома.
Дополнительная теория:
- Некоторые правила определения степеней окисления элементов в химических соединениях
- Оксиды. Классификация. Свойства. Номенклатура
- Кислоты и основания. Классификация. Свойства. Номенклатура
- Соли. Классификация. Свойства. Номенклатура
- Способы выражения состава раствора в химии
Пример оформления задачи №1
Сколько граммов 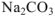 потребуется для приготовления 500
потребуется для приготовления 500 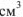 5%-ного раствора, плотность которого
5%-ного раствора, плотность которого 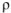 = 1,06г/
= 1,06г/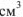 .
.
Решение:
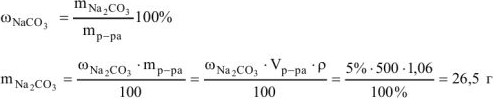
Пример оформления задачи №2
Рассчитать массовую долю соли в растворе (% масс.), если имеется раствор, содержащий 25 г 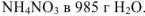
Решение:
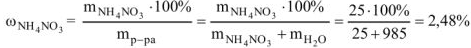
Молярная доля растворенного вещества (В) (обозначение 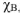 . безразмерная величина). Определяется как отношение числа моль растворенного вещества (
. безразмерная величина). Определяется как отношение числа моль растворенного вещества (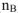 ) к сумме числа моль растворенного вещества (
) к сумме числа моль растворенного вещества (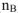 ) и числа моль растворителя (воды).
) и числа моль растворителя (воды).
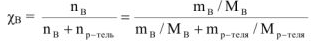 безразмерная величина
безразмерная величина
где 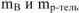 — соответственно массы растворенного вещества и растворителя, г;
— соответственно массы растворенного вещества и растворителя, г;
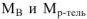 — соответственно молярные массы растворенного вещества и растворителя, г/моль.
— соответственно молярные массы растворенного вещества и растворителя, г/моль.
Пример оформления задачи №3
Определить молярную долю глюкозы  в водном растворе с массовой долей 10%.
в водном растворе с массовой долей 10%.
Решение:
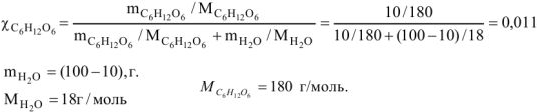
Пример оформления задачи №4
Рассчитать молярную долю соли в растворе, полученном растворением 5.85 г  .
.
Решение:
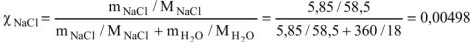
Титр растворенного вещества (В) (обозначение — 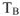 , единица измерения — г/
, единица измерения — г/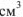 ) Это концентрация стандартного раствора, равная массе растворенного вещества (
) Это концентрация стандартного раствора, равная массе растворенного вещества (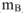 ), содержащейся в 1
), содержащейся в 1 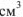 раствора.
раствора.
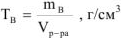
где 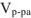 — объем раствора,
— объем раствора, 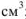 ;
;
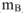 — масса растворенного вещества, г
— масса растворенного вещества, г
Не следует путать титр раствора и плотность раствора на основании похожести формулы и одинаковой размерности. Плотность раствора 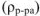 — это масса единицы объема раствора. Чтобы рассчитать плотность раствора необходимо массу некоторого образца раствора разделить на его объем.
— это масса единицы объема раствора. Чтобы рассчитать плотность раствора необходимо массу некоторого образца раствора разделить на его объем.
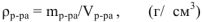
Например: Определить титр раствора, если в 500  этого раствора содержится 0.02 моль
этого раствора содержится 0.02 моль 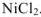 .
.
Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия
- Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия.
- Изобарный тепловой эффект химической реакции. Энтальпия. Стандартные энтальпия образования, сгорания и растворения химических веществ.
- I и II закон термохимии, I и II следствия из закона Гесса.
- Энтропия. Стандартная энтропия химических соединений. Расчет изменения энтропии химических реакций.
- Энергия Гиббса. Стандартная энергия Гиббса образования химических соединений. Расчет изменения энергии Гиббса химических реакций.
- Энергия Гиббса и направленность протекания химических реакций.
Любая химическая реакция сопровождается энергетическими эффектами в виде тепла, света, электричества и т.д. Раздел химии, который изучает закономерности превращения одних форм энергии в другие называется термодинамикой. Химическая термодинамика (К) рассматривает применение законов термодинамики химическим процессам.
Раздел химической термодинамики, изучающий тепловые эффекты реакции и их зависимость от химического состава и строения, а также от условий протекания реакции, называется термохимией. Законы термохимии позволяют рассчитывать тепловые эффекты химических реакций без постановки экспериментов.
Основные понятия.
Объектом изучения термодинамики является система.
Термодинамическая система совокупность веществ, физически или мысленно обособленных от окружающей среды.
Различают следующие виды систем:
- Открытые системы, в которых происходит обмен с окружающей средой, как энергией, так и веществом (химическая реакция в открытом сосуде).
- Замкнутые системы, в которых не происходит обмен с окружающей средой веществом, но возможен энергообмен (химическая реакция в закрытом сосуде).
- Изолированные системы, она является идеальной и в ней отсутствует обмен с окружающей средой как веществом так и энергией.
Совокупность физических и химических свойств системы определяет ее состояние. Состояние системы количественно характеризуется термодинамическими параметрами состояния.
Параметрами состояния называются величины, характеризующие свойства системы. К ним относятся, температура Т, давление Р, объем V, концентрация С, плотность  .
.
Параметры состояния, пропорциональные количеству вещества системы называются экстенсивными (объем, масса и т.д.).
Параметры состояния, не зависящие от количества вещества называются интенсивными (температура, давление и т.д.).
Изменение величины хотя бы одного из параметров приводит к изменению состояния системы в целом. Изменение состояния системы, т.е. переход ее из одного состояния в другое называется процессом. В зависимости от условий протекания процессов в системе различаются:
- Изотермические — протекающие при постоянной температуре (T=const).
- Изохорические — протекающие при постоянном объёме (V= const).
- Изобарические — протекающие при постоянном давлении (Р= const).
- Адиабатические — протекающие без теплообмена с окружающей средой (Q = 0).
Химические реакции часто протекают в изобарно- и изотермических условиях (Р= const, T=const), например, при взаимодействии между веществами в открытых сосудах без нагревания или при более высокой, но постоянной температуре. Иногда, для химических реакций соблюдаются изохорно-изотермические условия (V= const. T=const).
Величины, характеризующие свойства термодинамических систем, определяемые изменением параметров состояния, называются термодинамическими функциями.
Термодинамические функции являются функциями состояние и их значения не зависят от пути протекания процесса, а определяются только начальным и конечным состоянием.
Каждая система обладает определенным запасом энергии — Е — это мера работоспособности системы. Энергия является свойством системы. Передача энергии от системы к системе может осуществляться в виде двух форм — теплоты и работ.
Q — теплота — мера энергии, переданная от одной системы к другой за счет разности температур систем. Теплота является микроскопической формой передачи энергии от молекулы к молекуле за счет их столкновения.
W — работа — мера энергии, переданная от одной системы к другой за счет перемещения масс под действием силы. Работа является макроскопической формой передачи энергии.
Теплота и работа не являются свойством системы, и поэтому не являются функциями состояния и их величина зависит от пути протекания процесса, т.е. теплота и работа являются функциями процесса.
Тепловым эффектом химической реакции называется изменение энергии системы при протекание в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения.
Тепловой эффект химической реакции зависит от:
- массы реагирующих веществ;
- от их агрегатного состояния;
- от условий протекания процесса (Р, V, Т);
Для сравнения тепловых эффектов все рассматриваемые реакции протекают при стандартных условиях: Р = 100 кПа (760 мм.рт.ст.), Т = 298 К (25°С).
Нормальные условия:Р = 100 кПа(760 мм.рт.ст.), Т = 273 К (0°С).
Термохимическими уравнениями называются химические реакции с указанием агрегатного состояния реагирующих веществ, условия протекания, с указанием теплового эффекта, возможно дробные коэффициенты. Если реакция протекает с поглощением тепла, то она называется эндотермической, если реакция протекает с выделение теплоты, то это экзотермическая.
Тепловой эффект может быть отнесен или ко всей реакции (измеряется в кДж) или к одному молю любого участника реакции (измеряется кДж/моль). Например, для реакции:
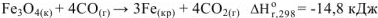
Тепловые эффекты реакции измеряются с помощью специальных приборов -калориметров.
Рассмотрим реакцию взаимодействия:
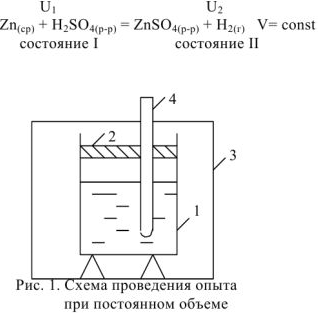
Для измерения величины теплового эффекта закроем реакционный сосуд (1), в котором находятся реагирующие вещества, неподвижным поршнем (2) и поместим сосуд в калориметр (3). При помощи термометра (4) измерим изменение температуры (рис. 1). При растворении цинка температура раствора повысится на 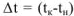 , а количество теплоты
, а количество теплоты 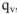 , выделенное при растворении
, выделенное при растворении 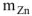 граммов в известной массе раствора
граммов в известной массе раствора 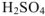 рассчитываем по уравнению
рассчитываем по уравнению
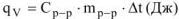
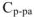 — удельная теплоемкость раствора (Дж/гК)
— удельная теплоемкость раствора (Дж/гК)
А количество теплоты, выделенное или поглощенное при растворении 1 моль цинка, протекающее при постоянном объеме 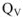 называется изохорным тепловым эффектом реакции
называется изохорным тепловым эффектом реакции
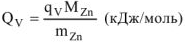
Для данной реакции 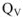 = 165,7 кДж/моль. Термохимическое уравнение будет иметь вид
= 165,7 кДж/моль. Термохимическое уравнение будет иметь вид
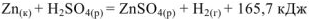
В общем виде изохорный тепловой эффект реакции
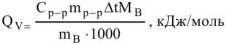
Выделение энергии в результате реакции обусловлены изменением внутренней энергии системы, которая обозначается (U).
Внутренняя энергия U — есть полная энергия системы, включающая в себя все виды энергии движения и взаимодействия молекул, атомов, ионов, электронов, внутриядерную и другие виды энергии, кроме кинетической энергии движения системы, как целого и потенциальной энергии ее положения.
Абсолютную величину внутренней энергии определить невозможно, можно только определить изменение внутренней энергии 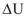 при переходе системы из начального состояния
при переходе системы из начального состояния 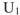 в конечное состояние
в конечное состояние 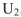 . Так как
. Так как 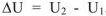 . Рассмотренная реакция, является экзотермической, за счет выделения теплоты уменьшается запас внутренней энергии системы. Следовательно, внутренняя энергия системы после протекания реакции
. Рассмотренная реакция, является экзотермической, за счет выделения теплоты уменьшается запас внутренней энергии системы. Следовательно, внутренняя энергия системы после протекания реакции  будет меньше внутренней энергии системы до протекания реакции
будет меньше внутренней энергии системы до протекания реакции  и поэтому изменение внутренней реакции будет отрицательным (рис. 2).
и поэтому изменение внутренней реакции будет отрицательным (рис. 2).
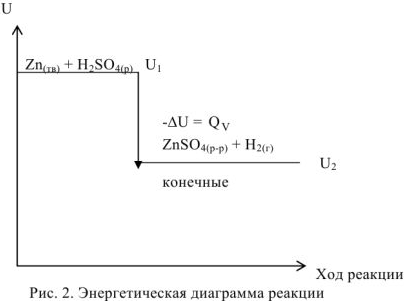
Следовательно, изохорный тепловой эффект реакции системы равен по величине и противоположен по знаку изменению внутренней энергии  . а для рассмотренной реакции
. а для рассмотренной реакции 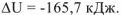 .
.
Таким образом, для экзотермических реакций изменение внутренней энергии отрицательна, 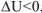 , а для эндотермических реакций — положительно,
, а для эндотермических реакций — положительно, 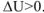
Таким образом, исторически сложились две системы записи термохимических уравнений, применяемые в термохимии и термодинамике, характеризующиеся взаимно обратными знаками тепловых эффектов.
Изобарный тепловой эффект химической реакции. Энтальпия. Стандартная энтальпия образования и сгорания химических веществ.
Проведем эту же экзотермическую реакцию в том, же калориметре, при постоянном давлении. Для этого реакционный сосуд закроем поршнем, который может свободно перемещаться в сосуде (рис. 3). При растворении цинка за счет выделившегося водорода объем системы будет возрастать, и поршень из положения 1 переместиться в положение 2. При этом давление остается постоянным. При растворении цинка в условиях постоянного давления температура раствора повысится на 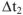 , а количество теплоты выделяющейся
, а количество теплоты выделяющейся 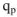 при растворении
при растворении 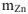 будет равно
будет равно
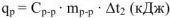
Тепловой эффект реакции, протекающей при постоянном давлении, отнесенное к 1 моль называется изобарным тепловым эффектом 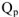 , может быть рассчитан по уравнению
, может быть рассчитан по уравнению
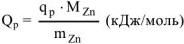
Для данной реакции 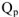 = 163,2 кДж/моль
= 163,2 кДж/моль
Термохимическое уравнение будет иметь вид:
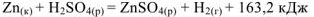
В общем виде изобарный тепловой эффект реакции
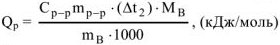
Как следует из приведенных термохимических уравнений изобарный тепловой эффект реакции 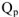 меньше изохорного теплового эффекта реакции
меньше изохорного теплового эффекта реакции 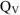 на величину
на величину 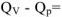 2,5 кДж/моль. Это обусловлено тем, что при протекании реакции при постоянном давлении эта часть энергии (2,5 кДж) расходуется на совершении системой работы расширения W против сил внешнего давления р.
2,5 кДж/моль. Это обусловлено тем, что при протекании реакции при постоянном давлении эта часть энергии (2,5 кДж) расходуется на совершении системой работы расширения W против сил внешнего давления р. 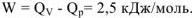 .
.
В общем случае работа расширения равна работе перемещения поршня площадью S на расстояние 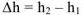 может быть рассчитана
может быть рассчитана
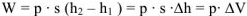
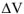 — изменение объема при протекании реакции.
— изменение объема при протекании реакции.
Для идеальных газов, используя ур. Менделеева-Клапейрона и последнее уравнение можно записать
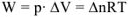
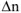 — изменение числа моль газообразных веществ в реакции, которое рассчитывается
— изменение числа моль газообразных веществ в реакции, которое рассчитывается 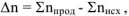 , где
, где
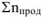 — суммарное число моль газообразных продуктов реакции
— суммарное число моль газообразных продуктов реакции
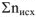 -суммарное число моль газообразных исходных веществ Следовательно, величина работы расширения нс зависит от природы газообразных веществ, а определяется только изменением числа моль газообразных веществ при протекании реакции и температурой.
-суммарное число моль газообразных исходных веществ Следовательно, величина работы расширения нс зависит от природы газообразных веществ, а определяется только изменением числа моль газообразных веществ при протекании реакции и температурой.
Для реакции растворения цинка, протекающей при температуре 298К, для которой 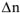 = 1, работа расширения равна
= 1, работа расширения равна 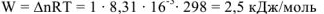
Взаимосвязь между изобарным и изохорным тепловыми эффектами реакция выражается уравнением 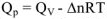
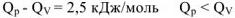
Пример оформления задачи №5
Рассчитать разность между изобарным и изохорным тепловыми эффектами для следующих реакций:
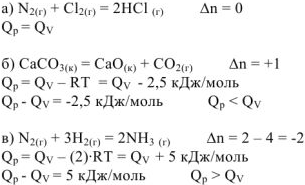
Решение:
Согласно первому закону термодинамики. Теплота, подводимая к системе, затрачиваемая на изменение внутренней энергии 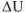 и совершение системой работы W против внешних сил
и совершение системой работы W против внешних сил
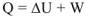
Приведенное уравнение выражает закон сохранения энергии согласно которому энергии нс может нс создаваться, ни исчезать, а может только превращаться из одной формы энергии в другую.
Для изобарного процесса тепловой эффект реакции равен изменению внутренней энергии системы плюс работа расширения
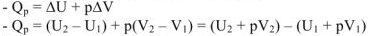
Обозначим 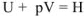 — эта функция называется энтальпией, тогда
— эта функция называется энтальпией, тогда
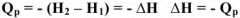
Значит, энтальпия равна внутренней энергии с учетом работы расширения. Энтальпия -эта энергии расширенной системы. Энтальпия является функцией состояния.
Абсолютную величину энтальпии, также как и абсолютную величину внутренней энергии определить невозможно.
Можно определить только изменение 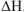 , как
, как 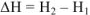
Для реакции растворения цинка в серной кислоте, протекающей при р = const изобарный тепловой эффект 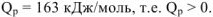 . В соответствии с рис. 4
. В соответствии с рис. 4 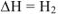
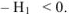
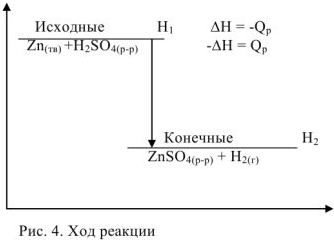
Следовательно, изобарный тепловой эффект численно равен и противоположен по знаку изменению энтальпии

Для экзотермических реакций 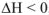 , для эндотермических
, для эндотермических 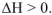 . Для реакций, протекающих при постоянном давлении, термохимическое уравнение записывается с указанием величины изменения энтальпии. Для экзотермической реакции растворения цинка при р = const термохимическое уравнение будет иметь вид:
. Для реакций, протекающих при постоянном давлении, термохимическое уравнение записывается с указанием величины изменения энтальпии. Для экзотермической реакции растворения цинка при р = const термохимическое уравнение будет иметь вид:
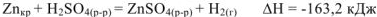
Изменение энтальпии 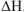 связано с изменением внутренней энергии и работой расширения
связано с изменением внутренней энергии и работой расширения
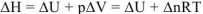
Если при протекании реакции число моль газообразных веществ не изменится, то 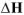
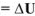
Величина изменения энтальпии (тепловой эффект) зависит от температуры и давления. Для того, чтобы можно их сравнивать, их относят к стандартным условиям.
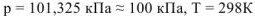
Изменение энтальпии (тепловых эффектов) химических реакций, отнесенные к стандартным условиям, называется стандартными и обозначается 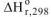
Поскольку определить абсолютное значение энтальпии невозможно, то в термодинамике пользуются величинами изменения энтальпии. В качестве точки отсчета за условный нуль принята энтальпия простых веществ, находящихся при стандартных условиях в устойчивом состоянии. Переход простых веществ из устойчивого состояния в менее устойчивое или образование химических соединений из устойчивых простых веществ сопровождается выделением или поглощением энергии.
Стандартный тепловой эффект реакции образования 1 моль вещества (неустойчивого простого или химического соединения) из простых веществ, находящихся в устойчивом состоянии, называется стандартной энтальпией образования вещества и обозначается 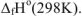
Энтальпия образования простых веществ, устойчивых при 298К и давлении 101,3 кПа, принимают равной нулю. Нулевое значение энтальпии образования имеет фаза или модификация вещества, наиболее устойчивая при 298К и давлении 101,3 кПа.
Пример оформления задачи №6

Решение:
Стандартная энтальпия образования оксида азота (II) равна тепловому эффекту реакции:
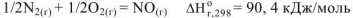
И следовательно, 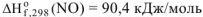
Числовые значения 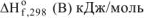 приводятся в справочных таблицах.
приводятся в справочных таблицах.
При расчете тепловых химических реакций с учетом органических веществ вместо энтальпии образования веществ более удобно использовать энтальпии сгорания веществ.
Стандартной энтальпией сгорания вещества называется тепловой эффект реакции полного сгорания 1 моль данного вещества до оксида углерода (IV) и жидкой воды. Энтальпии сгорания веществ обозначаются 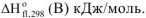 .
.
Энтальпии сгорания всех веществ отрицательны, так как реакция горения всегда является экзотермической. Энтальпии сгорания негорючих веществ равны нулю.
Энтальпия сгорания органических веществ приводятся в справочниках.
Пример оформления задачи №7
Указать, какая из перечисленных реакций является эндотермической:
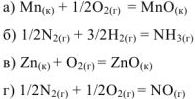
Решение:
Т.к. все указанные реакции являются реакциями образования 1 моль вещества из простых веществ, то изменение энтальпии приведенных процессов есть стандартная энтальпия образования этих веществ. Для определения теплового эффекта реакций выписываем табличные данные энтальпий образования каждого из участников реакций:
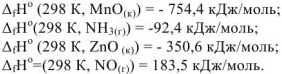
Так как реакция (г) имеет положительное значение изменения энтальпии, то эта реакция является эндотермической.
I и II закон термохимии. I и II следствия из закона Гесса
Термохимические законы используются для расчетов тепловых эффектов химических реакций  изменений энтальпий).
изменений энтальпий).
Первый закон термохимии открыт А.Лавуазье и П. Лапласом в в 1784 г.
«Тепловой эффект реакции разложения химического соединения равен по величине и противоположен по знаку тепловому эффекту его образования)
Например: 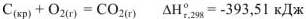

Второй закон термохимии был открыт русским ученым Г.И. Гессом в 1840 г.
«Тепловой эффект реакции зависит только от начального и конечного состояния реагирующих веществ, но не зависит от промежуточных стадий реакции, т.е. от пути протекания процессов».
Закон Гесса устанавливает, что если из данных исходных веществ можно различными способами получить заданные конечные продукты, то независимо от способа получения и вида промежуточных стадий суммарное изменение теплового эффекта будет одним и тем же.
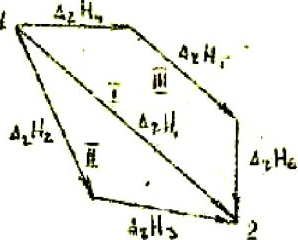
Рассмотрим превращение исходных веществ(состояние 1) (рис. 5) в продукты реакции (состояние 2). Протекание реакции возможно по трем путям I, II и III.
Согласно закону Гесса суммы тепловых эффектов для различных путей протекания реакции должны быть равны: 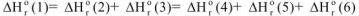
Закон Гесса позволяет рассчитать неизвестный тепловой эффект реакции, входящей в цикл, если для остальных реакций цикла тепловые эффекты реакции известны.
Пример оформления задачи №8
Рассчитать тепловой эффект реакций окисления углерода до оксида углерода (П).
Решение:
Экспериментально определить тепловой эффект этой реакции невозможно, так как при окислении углерода наряду с образованием оксида углорода (II) частично образуется и оксид углерода (IV). Тепловой эффект реакции получения оксида углерода (II) можно определять только расчетным путем, используя закон Гесса.
Оксид углерода (IV) можно получить из углерода и кислорода двумя путями:
1 .Непосредственным окислением углерода до оксида углерода (IV) по реакции
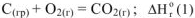
2.Путем промежуточного получения оксида углерода (11) с последующим его окислением до оксида углерода (1 V) по реакциям:
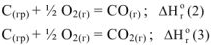
Экспериментально определены тепловые эффекты реакции (а)
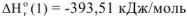 и реакции (в)
и реакции (в) 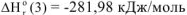
Составим энтальпийную диаграмму окисления углерода (рис. 6).
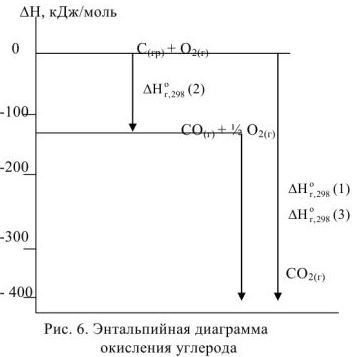
В соответствии с законом Гесса тепловые эффекты образования оксида углерода (IV) как непосредственно из простых веществ, гак и через промежуточную стадию образования оксида углерода (II) с последующим окислением, равны, тогда:
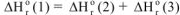
Откуда 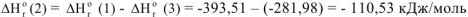
Следовательно, при окислении 1 моль углерода (II) выделяется 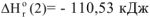 теплоты.
теплоты.
Пример оформления задачи №9
По заданным термохимическим уравнениям рассчитать стандартную энтальпию реакции образования 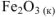 из простых веществ
из простых веществ
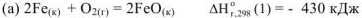
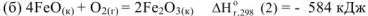
Решение:
Так как стандартная энтальпия образования 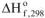 — это количество теплоты, которое выделяется или поглощается при образовании 1 моль вещества при стандартных условиях, то реакция образования оксида железа (III) имеет вид:
— это количество теплоты, которое выделяется или поглощается при образовании 1 моль вещества при стандартных условиях, то реакция образования оксида железа (III) имеет вид:
По закону Гесса тепловой эффект реакции не зависит от пути протекания процесса, а определяется только конечным и начальным состоянием системы, поэтому исходя из уравнений (а) и (б) нужно получить уравнения (в), используя алгебраические действия (сложение, вычитание, умножение, деление).
В данном случае сложим уравнение (а) и (б), т.к. исходное вещество находится в левой части уравнения, а продукты реакции в правой части уравнения (б), предварительно разделив уравнение (б) на 2. Таким образом, при этих математических действиях с уравнениями (а) и (б) сокращается промежуточный продукт 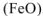 .
.
В результате получаем следующую реакцию
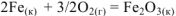
Аналогичные математические действия осуществляем и с тепловыми эффектами уравнений (а) и (б)
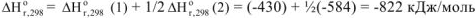
Ответ: 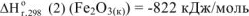
Следствие из закона Гесса
Позволяют производить расчеты тепловых эффектов химических реакций по энтальпиям (тсплотам) образования и энтальпиям (теплотам) сгорания химических соединений.
Расчет тепловых эффектов реакций по энтальпиям образования химических соединений
Рассмотрим реакцию:
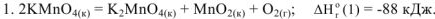
Запишем уравнение образования из простых веществ каждого из участников реакции и выпишем для них из таблиц стандартные энтальпии образования
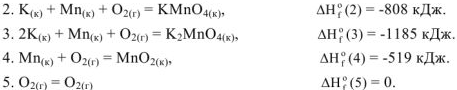
На основании закона Гесса реакция (1) может быть получена алгебраическим суммирование уравнений реакций (2); (3); (4); (5). Тогда изменение энтальпии реакции (1)равно:
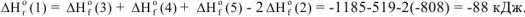
Из полученного уравнения вытекает 1 следствие из закона Гесса: «Изменение энтальпии (теплового эффекта) химической реакции равно сумме энтальпий образования (теплот образования) продуктов реакции за вычетом суммы энтальпий образования (тсплот образования) исходных веществ с учетом стехиометрических коэффициентов.
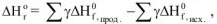
где 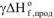 — энтальпии образования продуктов реакции
— энтальпии образования продуктов реакции
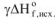 — энтальпии образования исходных веществ
— энтальпии образования исходных веществ
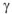 — стехиометрические коэффициенты.
— стехиометрические коэффициенты.
Пример оформления задачи №10
Рассчитать изменения стандартной энтальпии реакции химической реакции: 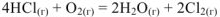
Решение:
Согласно первому следствию из закона Гесса:
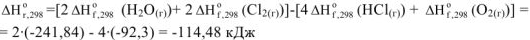
Пример оформления задачи №11
Стандартная энтальпия сгорания этилена 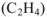 равна (-1410,8 кДж/моль). Написать термохимическое уравнение сгорания этилена и вычислить стандартную энтальпию его образования.
равна (-1410,8 кДж/моль). Написать термохимическое уравнение сгорания этилена и вычислить стандартную энтальпию его образования.
Решение:
Записываем термохимическое уравнение сгорания этилена, помня о том, что в термохимических уравнениях возможны дробные коэффициенты.
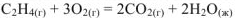
Так как стандартная энтальпия сгорания вещества — это тепловой эффект реакции полного сгорания 1 моль данного вещества до 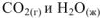 при стандартных условиях, то для нашей реакции
при стандартных условиях, то для нашей реакции
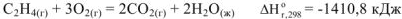
И согласно 1-му следствию из закона Гесса для нашей реакции
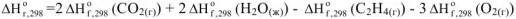
Используя справочные данные энтальпий образования 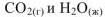 получим
получим 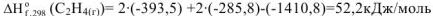
Пример оформления задачи №12
Процесс растворения веществ в воде состоит из последовательно протекающих процесса гидратации и процесса растворения гидратированных частиц вещества. Изменение энтальпии гидратации можно рассчитать, если известны изменения энтальпии при растворении безводного вещества и его кристаллогидрата.
Определить стандартное изменение энтальпии при образовании кристаллогидрата.
Решение:
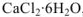 , если изменение энтальпии при растворении безводной соли составляет
, если изменение энтальпии при растворении безводной соли составляет
 , а изменение энтальпии при растворении кристаллогидрата
, а изменение энтальпии при растворении кристаллогидрата 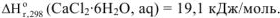 . Процесс растворения можно выразить в виде схемы (рис. 7)
. Процесс растворения можно выразить в виде схемы (рис. 7) 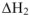 .
.
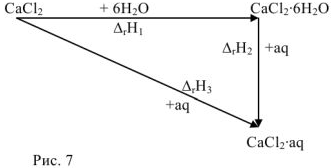
Тогда в соответствии с законом Гесса 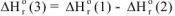
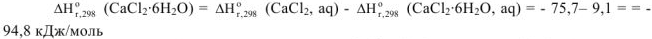
При образовании 1 моль кристаллогидрата  выделяется 94,8 кДж теплоты.
выделяется 94,8 кДж теплоты.
Пример оформления задачи №13
Определить стандартное изменение энтальпии  реакции горения метана:
реакции горения метана:
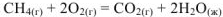
а) по закону Гесса, знал, что стандартные энтальпии образованы

б) используя 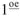 следствие закона Гесса.
следствие закона Гесса.
Решение:
а) Запишем термохимические уравнение реакций образовано, 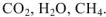 .
.
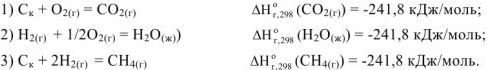
Согласно з-ну Гесса изменение энтальпии (теплового эффекта) реакции зависит только от начального и конечного состояния участвующих в реакции веществ и нс зависит от промежуточных стадий процесса.
Сложим уравнение (1) с удвоенным уравнением (2) и вычтим из найденной суммы уравнение (3) и получим термохимическое уравнение заданной реакции
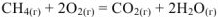
Аналогичные действия проведем с энтальпиями образования этих веществ:
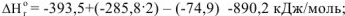
б) Используя следствие закона Гесса:
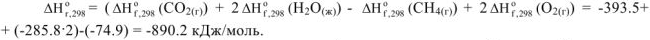
Расчет тепловых эффектов реакции по энтальпиям (теплотам) сгорания веществ
Для расчета тепловых эффектов реакций, протекающих между органическими веществами, удобнее воспользоваться энтальпиями (теплотами) сгорания веществ.
Рассмотрим реакцию 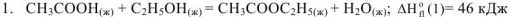
Запишем уравнения реакций сгорания всех участников реакции и табличные величины энтальпий сгорания
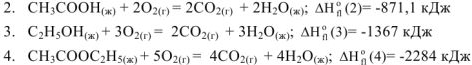
Производя алгебраическое суммирование уравнений (2), (3), (4) получаем уравнение (1).
Тогда изменение энтальпии химической реакции (1) будет равно
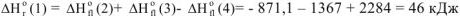
Отсюда вытекает II следствие из закона Гесса: «Тепловой эффект химической реакции равен сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов»:
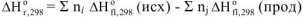
где  — стехиометрические коэффициенты,
— стехиометрические коэффициенты,
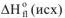 — энтальпия сгорания исходных веществ
— энтальпия сгорания исходных веществ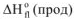 — энтальпия сгорания продуктов реакции
— энтальпия сгорания продуктов реакции
Пример оформления задачи №14
Написать формулу для расчета энтальпии растворения вещества, указать единицу измерения.
Решение:
Теплота растворения (энтальпия растворения) зависит от природы растворителя и растворяемого вещества. Может сопровождаться понижением температуры, если при растворении преобладает тепловой эффект разрушения кристаллической решетки
растворяемого вещества, а также может сопровождаться повышением температуры, если при растворении преобладает тепловой эффект гидратации (растворитель вода). Расчет ведется по формуле:
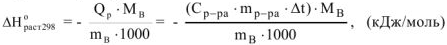
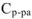 — удельная теплоемкость раствора (Дж/г К)
— удельная теплоемкость раствора (Дж/г К)
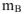 — масса растворенного вещества
— масса растворенного вещества
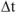 — изменение температуры в процессе
— изменение температуры в процессе
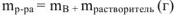
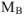 — молярная масса растворяемого вещества
— молярная масса растворяемого вещества
Направленность химических процессов
При изучении химических процессов необходимо уметь оценивать возможность самопроизвольного протекания химических реакций при заданных условиях. Процесс называют самопроизвольным, если для его протекания не требуется затрачивать работу.
В середине XIX века Ю.Томсен и А.Бертло по аналогии с механическим движением выдвинули принцип, согласно которому самопроизвольное протекание химических процессов может происходить только в сторону уменьшения внутренней энергии системы, т.е. самопроизвольно могут протекать только реакции, идущие с выделением энергии. Действительно, при низких температурах самопроизвольно протекают только экзотермические реакции. Однако при более высоких температурах возможно самопроизвольное протекание и эндотермических реакций.
Например, эндотермическая реакция 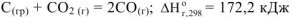 протекает при температуре Т= 1000-1200 К. Поэтому знак и величина теплового эффекта химических реакций не могут однозначно характеризовать возможности их протекания.
протекает при температуре Т= 1000-1200 К. Поэтому знак и величина теплового эффекта химических реакций не могут однозначно характеризовать возможности их протекания.
Критерии возможности самопроизвольного протекания процесса в заданном направлении выводятся на основании II закона термодинамики, который позволяет также установить и предел протекания химических реакций. Такими критериями для процессов, протекающих при различных условиях, являются термодинамические функции — энтропия, энергия Гиббса и энергия Гельмгольца.
Энтропия
Рассмотрим процесс, протекающий в изолированной системе, в которой отсутствует теплообмен с окружающей средой. Для таких процессов изменение внутренней энергии или энтальпии равно нулю 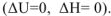
Возьмем 2 сосуда, в которых находятся инертные газы — аргон и гелий. Если соединить эти сосуды, го начнется взаимная диффузия газов и через некоторое время концентрации газов в обоих сосудах выравняются. Процесс выравнивания концентрации газов происходит самопроизвольно. Обратный процесс разделения газов самопроизвольно происходить нс может. Система из состояния с меньшей степенью неупорядоченности переходит в состояние с большей степенью неупорядоченности. Следовательно, более неупорядоченное состояние в природе является более вероятным и самопроизвольно должны протекать процессы, сопровождающиеся увеличением неупорядоченности системы.
Количественной мерой неупорядоченности системы является термодинамическая функция — энтропия, S. Энтропия может быть выражена через термодинамическую вероятность.
Любая система характеризуется макро- и микросостояниями. Макросостояние системы есть среднестатистическая величина, характеризующая средние свойства множества частиц
в системе. Эта величина не отражает состояние каждой частицы. Макросостояние системы характеризуется термодинамическими параметрами: давлением — р, объемом — V и температурой — Т. Микросостояние каждой частицы (скорость и направление се движения в пространстве) непрерывно изменяется за счет хаотического движения частиц системы. Одному и тому же макросостоянию системы соответствует большое число различных микросостояний, отличающихся положением и скоростями движущихся частиц.
Термодинамической вероятностью <о называется число микросостояний, отвечающее данному макросостоянию. Чем большее число микросостояний отвечает данному макросостоянию, т.е. чем больше неупорядоченность системы, тем больше термодинамическая вероятность данного состояния, т.е. тем легче это состояние возникает.
Связь между термодинамической вероятностью w и энтропией S выражается уравнением Больцмана
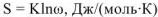
где К- постоянная Больцмана. Дж/(моль К).
Из уравнения следует, что чем больше неупорядоченность системы, тем больше величина энтропии. Отсюда энтропия есть мера неупорядоченности состояния системы.
Для рассмотренного выше процесса самопроизвольного смешения газов можно записать, что энтропия в начальном состоянии 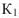 , а энтропия в конечном состоянии
, а энтропия в конечном состоянии 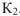 .
.
Так как термодинамическая вероятность конечного состояния 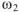 больше термодинамической вероятности исходного состояния
больше термодинамической вероятности исходного состояния 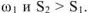 . Следовательно,
. Следовательно, 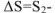
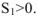 . Отсюда можно сделать вывод, что в изолированных системах самопроизвольно протекают только такие процессы, которые направлены в сторону увеличения энтропии.
. Отсюда можно сделать вывод, что в изолированных системах самопроизвольно протекают только такие процессы, которые направлены в сторону увеличения энтропии.
Критерием возможности самопроизвольного протекания процессов в изолированных системах является условие 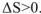 .
.
Самопроизвольное протекание процесса будет проходить до тех пор, пока энтропия не достигнет максимального значения. При этом изменение энтропии становится равным нулю 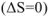 и в системе наступает равновесие. Экспериментально определить величину энтропии невозможно. Значения энтропии для веществ получают расчетным путем. При расчете энтропии вещества за начальное состояние принимается температура абсолютного нуля. В соответствии с III законом термодинамики, «Энтропия идеального кристалла простого вещества при температуре абсолютного нуля равна нулю», т.е.
и в системе наступает равновесие. Экспериментально определить величину энтропии невозможно. Значения энтропии для веществ получают расчетным путем. При расчете энтропии вещества за начальное состояние принимается температура абсолютного нуля. В соответствии с III законом термодинамики, «Энтропия идеального кристалла простого вещества при температуре абсолютного нуля равна нулю», т.е. 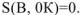 . Энтропия веществ при любой температуре, отличной от абсолютного нуля, всегда больше нуля, так как при Т=0К всегда имеет место движение частиц вещества.
. Энтропия веществ при любой температуре, отличной от абсолютного нуля, всегда больше нуля, так как при Т=0К всегда имеет место движение частиц вещества.
Изменение энтропии при образовании вещества В можно рассчитать как 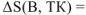
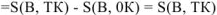
Поэтому изменение энтропии при образовании вещества В при любой температуре численно равно энтропии вещества при этой температуре. Для того, чтобы можно было сравнивать энтропии различных веществ, а также определять изменение энтропии в различных процессах, их относят к стандартным условиям. Такие энтропии называются стандартными энтропиями веществ и обозначаются S° (298К. В).
Стандартные энтропии веществ приводятся и справочниках. Единица измерения Дж/(моль К). Стандартные энтропии простых веществ в отличие от стандартных энтальпий образования простых веществ не равны нулю и всегда положительны.
Энтропия, как мера неупорядоченности системы, зависит от температуры, агрегатного состояния вещества, состава вещества и его массы. Повышение температуры вызывает увеличение скорости движения частиц, поэтому возрастает степень беспорядка в системе, а вместе с ней и энтропия. Энтропия увеличивается при плавлении, испарении, сублимации, растворении веществ.
Например, в процессе фазовых переходов волы из твердого состояния в парообразное, ее энтропия изменяется следующим образом:
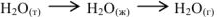
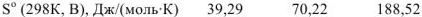
Следовательно, 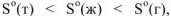 , что обуславливается увеличением степени неупорядоченности молекул при переходе вещества от твердого состояния к газообразному.
, что обуславливается увеличением степени неупорядоченности молекул при переходе вещества от твердого состояния к газообразному.
Аналогичная зависимость имеет место и при усложнении состава вещества. Например, в процессе превращения атомарного кислорода в озон, энтропия системы возрастает в следующей последовательности
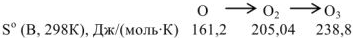
Энтропия является аддитивной величиной, т.е. пропорциональна количеству вещества в системе. Следовательно, общая энтропия системы  равна сумме энтропии се составных S, частей
равна сумме энтропии се составных S, частей
Расчет изменения энтропии
Изменение энтропии при фазовых переходах:
Фазовые переходы происходят при постоянной температуре (изотермический процесс). Поэтому изменение энтропии при переходе вещества из одного агрегатного состояния в другое 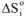 можно рассчитать по уравнению
можно рассчитать по уравнению
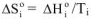
где 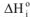 — изменение энтальпии при фазовом переходе;
— изменение энтальпии при фазовом переходе;
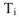 — температура фазового перехода (К); i — вид фазового перехода.
— температура фазового перехода (К); i — вид фазового перехода.
При увеличении неупорядоченности системы (плавление, испарение, сублимация) энтропия системы возрастает, так как на разрыв связей затрачивается внешняя энергия 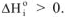 . При упорядочивании системы (кристаллизация, конденсация) энтропия системы уменьшается, так как при этом выделяется энергия,
. При упорядочивании системы (кристаллизация, конденсация) энтропия системы уменьшается, так как при этом выделяется энергия, 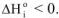 .
.
Изменение энтропии в химических процессах.
Энтропия также как внутренняя энергия и энтальпия является функцией состояния и ее изменение не зависит от пути протекания процесса. Поэтому для расчета изменения энтропии в химической реакции можно использовать 1 следствие из закона Гесса
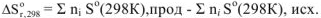
где 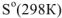 , прод — энтропии продуктов реакции;
, прод — энтропии продуктов реакции; 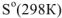 . исх. — энтропии исходных веществ;
. исх. — энтропии исходных веществ; 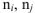 — стехиометрические коэффициенты.
— стехиометрические коэффициенты.
Пример оформления задачи №15
Вычислить изменение энтропии для реакции, если известны стандартные энтропии веществ.
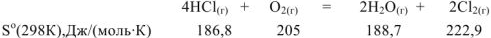
Решение:
На основании I следствия из закона Гесса можно записать
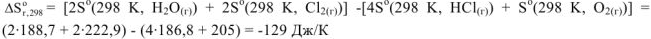
Следовательно, при протекании рассмотренной реакции энтропия системы убывает на 129 Дж/К.
Об изменении энтропии в химической реакции можно качественно судить по изменению объема реакционной смеси при протекании реакции. Так в реакции
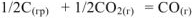

на 1/2 моль исходного газообразного вещества оксида углерода (IV) образуется I моль газообразного продукта реакции — оксида углерода (II). Объем системы увеличивается, 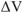 =
= 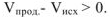 . При этом увеличивается и энтропия системы:
. При этом увеличивается и энтропия системы: 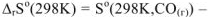
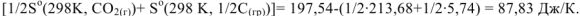
В реакции
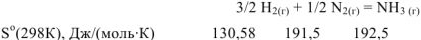
из 2 моль газообразных исходных веществ образуется I моль газообразного продукта реакции. Объем системы уменьшается, 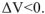 При этом уменьшается и энтропия системы,
При этом уменьшается и энтропия системы,
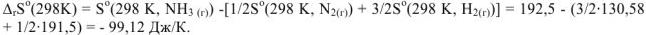
В реакции
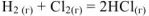

объем системы останется постоянным, 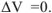 При этом и изменение энтропии системы близко к нулю,
При этом и изменение энтропии системы близко к нулю, 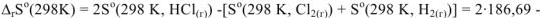
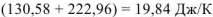
Энергия Гиббса и Гельмгольца
Большинство химических процессов не являются изолированными. Поэтому условие принципиальной возможности протекания изолированных процессов в этом случае является неприемлемым. Самопроизвольное протекание химических процессов обусловлено действием двух факторов: стремлением системы перейти в состояние с меньшим запасом энергии, сопровождающееся уменьшением энтальпии (ДНО), объединением частиц и переходом системы в более упорядоченное состояние, и стремлением системы перейти в состояние с большей степенью неупорядоченности, сопровождающееся увеличением энтропии (AS>0) и разъединением частиц. Оба фактора действуют независимо друг от друга.
Суммарное воздействие этих двух факторов на систему может быть количественно охарактеризовано с помощью термодинамических функций; энергии Гиббса — G и энергии Гельмгольца — А. Для вывода этих функций рассмотрим II закон термодинамики. В тепловой машине (см. рис.) часть теплоты, поступающей от нагревателя, превращается в работу, а другая часть теплоты передастся холодильнику. Применительно к тепловым процессам II закон термодинамики гласит: «Теплота может переходить в работу только при наличии разности температур, и не полностью, а с термическим коэффициентом полезного действия меньшим единицы».
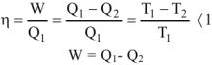
где 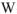 — работа, совершаемая тепловой машиной;
— работа, совершаемая тепловой машиной; 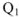 — общее количество теплоты, подведенное к машине от нагревателя с температурой
— общее количество теплоты, подведенное к машине от нагревателя с температурой 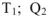 — количество теплоты, переданное от тепловой машины к холодильнику с температурой
— количество теплоты, переданное от тепловой машины к холодильнику с температурой 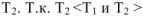
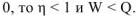
Рис. 8 Схема превращения теплоты в работу в паровой машине.
Таким образом, в тепловых машинах в работу может превращаться только часть теплоты — 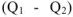 — свободная энергия. Другая часть теплоты
— свободная энергия. Другая часть теплоты 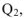 , передаваемая холодильнику, не способна превращаться в работу — связанная энергия. Эта часть энергии рассеивается в окружающее пространство. Количество связанной энергии зависит от температуры (Т) и энтропии системы (S) и может быть рассчитано
, передаваемая холодильнику, не способна превращаться в работу — связанная энергия. Эта часть энергии рассеивается в окружающее пространство. Количество связанной энергии зависит от температуры (Т) и энтропии системы (S) и может быть рассчитано 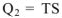 . Исходя из данного уравнения, энтропию можно рассматривать как количественную меру обесценивания (связывания) энергии. На основании II закона термодинамики можно сделать вывод, что количество работы, производимое любой системой, определяется нс общим количеством энергии, а только количеством свободной энергии. Применительно к химическим процессам II закон термодинамики показывает, что в химических реакциях так же. как и в тепловых процессах, в работу может превращаться только свободная химическая энергия, являющаяся частью общей химической энергии.
. Исходя из данного уравнения, энтропию можно рассматривать как количественную меру обесценивания (связывания) энергии. На основании II закона термодинамики можно сделать вывод, что количество работы, производимое любой системой, определяется нс общим количеством энергии, а только количеством свободной энергии. Применительно к химическим процессам II закон термодинамики показывает, что в химических реакциях так же. как и в тепловых процессах, в работу может превращаться только свободная химическая энергия, являющаяся частью общей химической энергии.
Для химических процессов, протекающих при 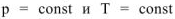 (изобарноизотермические процессы), выражение для свободной энергии по аналогии с уравнением W =
(изобарноизотермические процессы), выражение для свободной энергии по аналогии с уравнением W = 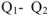 может быть записано в виде:
может быть записано в виде: 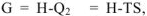 , где G -энергия Гиббса свободная энергия системы, способная переходить в работу: Н — энтальпия системы — общее количество энергии в системе; TS — связанная энергия — часть энергии, неспособная превращаться в работу.
, где G -энергия Гиббса свободная энергия системы, способная переходить в работу: Н — энтальпия системы — общее количество энергии в системе; TS — связанная энергия — часть энергии, неспособная превращаться в работу.
Для химических процессов, протекающих при V = const и Т = const (изохорноизотермические процессы), выражение для свободной энергии можно записать в виде: 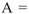
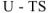 где А- энергия Гельмгольца — свободная энергия системы, способная переходить в работу: U — внутренняя энергия — общее количество энергии в системе.
где А- энергия Гельмгольца — свободная энергия системы, способная переходить в работу: U — внутренняя энергия — общее количество энергии в системе.
Абсолютное значение энергии Гиббса и Гельмгольца рассчитать нельзя, так как невозможно определить абсолютные значений энтальпии и внутренней энергии. Однако можно рассчитать изменение свободной энергии при протекании процесса. Так как энергии Гиббса и Гельмгольца являются функциями состояния, то их изменение не зависит от пути протекания процесса и может быть рассчитано как:  где:
где: 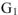 и
и 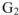 — энергия Гиббса соответственно в начальном и конечном состояниях системы;
— энергия Гиббса соответственно в начальном и конечном состояниях системы; 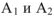 — энергия Гельмгольца соответственно в начальном и конечном состояниях системы. Тогда в соответствии с уравнениями можно записать:
— энергия Гельмгольца соответственно в начальном и конечном состояниях системы. Тогда в соответствии с уравнениями можно записать: 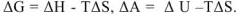 . Взаимосвязь между основными термодинамическими функциями может быть представлена в виде следующей схемы.
. Взаимосвязь между основными термодинамическими функциями может быть представлена в виде следующей схемы.
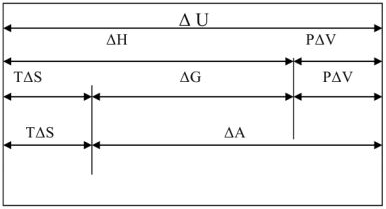
Рис. 9 Взаимосвязь между термодинамическими функциями.
Как следует из рисунка, энергия Гиббса 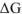 по величине меньше энергии Гельмгольца
по величине меньше энергии Гельмгольца 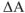 , гак как энтальпии
, гак как энтальпии 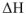 меньше изменения внутренней энергии
меньше изменения внутренней энергии 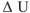 на величину работы расширения
на величину работы расширения 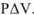 .
.
Дополнительная теория:
- Изменений энергии Гиббса и Гельмгольца как критерий направленности химических реакций
- Факторы, влияющие на направленность химических процессов
- Методы расчета изменения энергии Гиббса
Пример оформления задачи №16
Рассчитать энергию Гиббса реакции по значениям энергий Гиббса образования веществ и сделать вывод о возможности самопроизвольного протекания процесса:
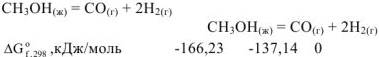
Решение:
Рассчитываем изменение энергии Гиббса реакции:
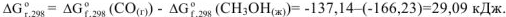
Так как энергия Гиббса имеет положительное значение, то в прямом направлении самопроизвольно реакция протекать нс будет.
По стандартным энтальпиям образования и стандартным энтропиям веществ. Если отсутствуют величины стандартных энергий Гиббса образования веществ или реакция протекает при температуре, отличной от стандартной, то, принимая в первом приближении, что энтальпия образования и энтропии веществ не зависят от температуры, изменение энергии Гиббса химической реакции при любой температуре 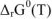 можно рассчитать по уравнению
можно рассчитать по уравнению
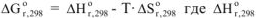 — изменение стандартной энтальпии реакции,
— изменение стандартной энтальпии реакции,
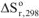 — изменение стандартной энтропии реакции; Т — температура протекания реакции.
— изменение стандартной энтропии реакции; Т — температура протекания реакции.
Стандартное изменение энтальпии и энтропии реакции рассчитывается на основании Следствия из закона Гесса.
Возможность самопроизвольного протекания реакции при 360 К определяется знаком величины изменения Гиббса:
если 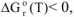 , самопроизвольное протекание реакции возможно;
, самопроизвольное протекание реакции возможно;
если 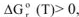 , то при заданной температуре реакция невозможна.
, то при заданной температуре реакция невозможна.
Значение 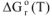 рассчитываем по формуле:
рассчитываем по формуле:
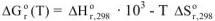
где 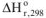 — изменение стандартной энтальпии реакции, кДж:
— изменение стандартной энтальпии реакции, кДж: 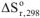 — изменение стандартной энтропии реакции, Дж/К:
— изменение стандартной энтропии реакции, Дж/К:
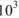 — пересчет кДж в Дж.
— пересчет кДж в Дж.
Ионное произведение воды. pH растворов. Произведение растворимости. Ионно-молекулярные уравнения
Ионное равновесие воды
Известно, что вода обладает определенной электрической проводимостью, которая увеличивается при повышении температуры. Значит, молекулы воды можно рассматривать как слабый электролит, который диссоциирует на ионы водорода и гидроксид-ионы:
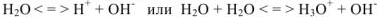
Учитывая, что только одна молекула из 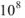 молекул
молекул 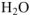 диссоциирует на ионы
диссоциирует на ионы 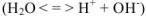 можно записать константу равновесия диссоциации.
можно записать константу равновесия диссоциации.
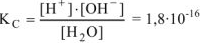
Малая величина 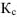 свидетельствует о том, что концентрация
свидетельствует о том, что концентрация 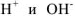 в воде ничтожна. Следовательно, равновесная концентрация воды [
в воде ничтожна. Следовательно, равновесная концентрация воды [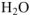 ] в таком растворе с большой степени точности равна исходной концентрации воды. Зная, что в литре чистой воды содержится 55,56 моль:
] в таком растворе с большой степени точности равна исходной концентрации воды. Зная, что в литре чистой воды содержится 55,56 моль:
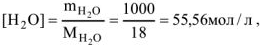 т.е. величина постоянная, которую можно ввести в константу.
т.е. величина постоянная, которую можно ввести в константу.
и тогда: 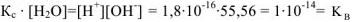
Т.е. 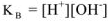
При 298К является величиной постоянной и называется ионным произведением воды.
Так как процесс диссоциации молекул воды эндотермичен, то согласно принципу Ле-Шателье при повышении температуры равновесие сместится слева направо 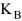 будет увеличиваться, а с понижением температуры уменьшаться
будет увеличиваться, а с понижением температуры уменьшаться

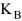 применяется не только для воды, но и для водных растворов любых веществ.
применяется не только для воды, но и для водных растворов любых веществ.
Ионное произведение воды — весьма важная величина, так как позволяет для любого водного раствора найти концентрацию 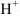 при известной концентрации
при известной концентрации 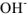 и наоборот.
и наоборот.

В соответствии с теорией электролитической диссоциации ионы 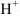 являются носителями кислотных свойств, а ионы
являются носителями кислотных свойств, а ионы 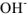 — носителями основных свойств. Поэтому раствор будет нейтральным, когда
— носителями основных свойств. Поэтому раствор будет нейтральным, когда 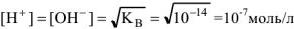 ; кислым
; кислым 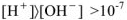 моль/л; щелочным
моль/л; щелочным 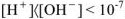 моль/л.
моль/л.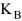 не зависит от концентрации
не зависит от концентрации 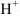 и
и 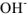 в растворе. Если добавить кислоту концентрация
в растворе. Если добавить кислоту концентрация 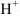 будет увеличиваться. Равновесие при этом, согласно принципу Ле Шатсльс сместится влево, а, следовательно, концентрация ионов
будет увеличиваться. Равновесие при этом, согласно принципу Ле Шатсльс сместится влево, а, следовательно, концентрация ионов 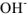 уменьшится, т.к.
уменьшится, т.к. 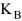 есть величина постоянная при данной температуре.
есть величина постоянная при данной температуре.
рН-растворов
Чтобы избежать отрицательных степеней для характеристики кислотности (щелочности) среды введен специальный параметр — водородный показатель или pH.
Водородным показателем, или pH называется взятый с обратным знаком десятичный логарифм концентрации ионов водорода в растворе:
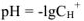
Водородный показатель определяет характер среды.
По аналогии введен показатель 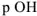 , равный
, равный 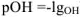 и показатель
и показатель 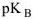 , равным
, равным 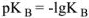 и тогда
и тогда 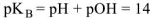
Таким образом, зная 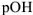 легко рассчитать pH и наоборот по известному значению pH легко определить
легко рассчитать pH и наоборот по известному значению pH легко определить 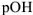 .
.
В нейтральном растворе 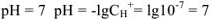
В щелочном растворе pH > 7, т.е. щелочная среда 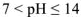
В кислом растворе pH < 7, т.е. кислая среда 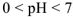
Соотношение между реакциями среды и значениями водородного показателя можно представить в виде схемы:
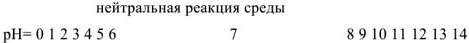
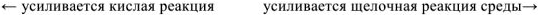
Пример оформления задачи №17
Вычислить pH следующих растворов: 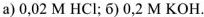 .
.
Решение:
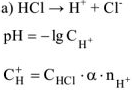
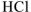 — сильный электролит,
— сильный электролит, 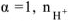 — число
— число 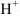 образовавшихся при диссоциациии одной молекулы
образовавшихся при диссоциациии одной молекулы 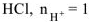 , тогда
, тогда 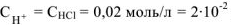 моль/л.
моль/л.
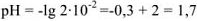
б) 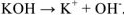 , т.к. среда диссоциации щелочная, то
, т.к. среда диссоциации щелочная, то 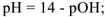
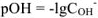
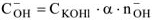
КОН — сильный электролит, 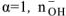 — число
— число 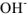 образовавшихся при диссоциациии одной молекулы КОН,
образовавшихся при диссоциациии одной молекулы КОН, 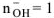 , тогда
, тогда 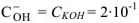 моль/л
моль/л
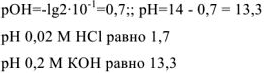
Пример оформления задачи №18
Вычислить pH 0.05 М раствора хлорноватистой кислоты
Решение:
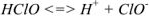
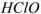 — слабый электролит
— слабый электролит
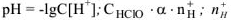 — число
— число 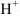 образовавшихся при диссоциациии одной молекулы
образовавшихся при диссоциациии одной молекулы 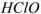 ,
, 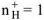 ,
,
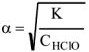
К — константа диссоциации 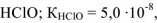 тогда
тогда

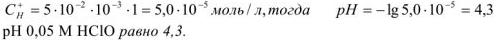
Пример оформления задачи №19
Вычислить pH 0,1 M раствора гидроксида аммония.
Решение:
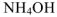 слабый электролит и в растворе диссоциирует
слабый электролит и в растворе диссоциирует
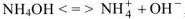 , тогда pH = 14 —
, тогда pH = 14 — 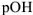
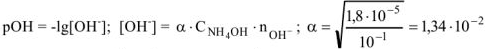 , тогда
, тогда
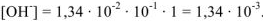 . Следовательно
. Следовательно 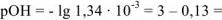 2,87
2,87
Водородный показатель имеет важное значение для понимания сути большинства процессов, протекающих в водной фазе (гидрометаллургия, пищевая, кинематографическая промышленность, сельское хозяйство и г.д.).
Для определения реакции среды обычно применяют индикаторы, которые изменяют окраску в зависимости от концентрации ионов водорода и гидроксила. Они представляют собой слабодиссоциирующис органические кислоты.
Распространенными индикаторами являются фенолфталеин, лакмус, метиловый оранжевый и др. Например, в щелочных средах раствор фенолфталеина окрашивается в малиново-красный цвет, в кислых — обесцвечивается. Лакмус при любых значениях кислотной среды имеет красную окраску, а щелочной — становится ярко-синий. Метиловый оранжевый в кислой среде — красный, а в щелочной окрашивается в желтый цвет.
В промышленности разработаны прецизионные инструментальные методы измерения водородного показателя и соответствующие приборы, называемые рН-метры.
Произведение растворимости
Растворимостью называется способность вещества растворяться в том или ином растворителе.
Процесс растворения сопровождается значительным возрастанием энтропии системы, т.к. в результате равномерного распределения одного и того же вещества в другом резко увеличивается число микроскопических состояний системы, обуславливающих макроскопические свойства системы, т.е. 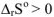
Поэтому, несмотря на 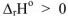 (эндотермичный процесс)
(эндотермичный процесс) 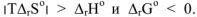 Растворение протекает самопроизвольно.
Растворение протекает самопроизвольно.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора. Поэтому растворимость может быть численно выражена теми же способами, что и концентрация. Например, в процентах растворенного вещества или в г*моль на 1 л раствора. Часто растворимость выражают числом массовых частей безводного вещества, насыщающих при данных условиях 100 масс, частей растворителя.
Растворимость различных веществ в воде колеблется в широких пределах. Если в 100 г  растворяется более 10 г вещества, то вещество обладает хорошей растворимостью; если растворителя менее 1 г — малорастворимое, если растворителя менее 0,01 г — нерастворимое вещество. Однако, практически совсем нерастворимых соединений нет.
растворяется более 10 г вещества, то вещество обладает хорошей растворимостью; если растворителя менее 1 г — малорастворимое, если растворителя менее 0,01 г — нерастворимое вещество. Однако, практически совсем нерастворимых соединений нет.
Довольно большое количество химических соединений обладает ограниченной растворимостью в воде или иных растворителях. Поэтому на практике часто приходится встречаться с равновесными системами, состоящими из малорастворимого вещества и его ионов в насыщенном растворе.
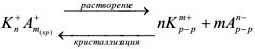
Вследствие динамического характера равновесие в этой гетерогенной системе устанавливается между процессами растворения труднорастворимого электролита н процессом кристаллизации и его соответствующих ионов.
Для процесса 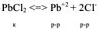
Так как соли являются сильными электролитами, а в константу равновесия не входит концентрация кристаллического вещества 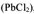 . то
. то
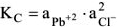
Поскольку электролит труднорастворимый, то I (ионная сила раствора) стремится к нулю, а коэффициент активности тонов 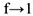 , следовательно, в выражении константы равновесия активности ионов можно заменить их равновесными концентрациями. Т.е.
, следовательно, в выражении константы равновесия активности ионов можно заменить их равновесными концентрациями. Т.е.
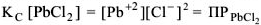
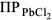 — произведение растворимости — постоянная безразмерная величина при данной (25°С) температуре.
— произведение растворимости — постоянная безразмерная величина при данной (25°С) температуре.
Как любая константа равновесия, произведение растворимости зависит от природы растворенного вещества и растворителя, от температуры и нс зависит от концентраций ионов в растворе.
Знание произведения растворимости позволяет рассчитать растворимость вещества (Пример 1), а знание растворимости позволяет рассчитать произведение растворимости (пример 2 ,3).
Дополнительная теория:
Пример оформления задачи №20
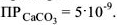 . Определить растворимость
. Определить растворимость 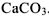 .
.
Решение:
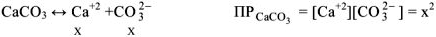
откуда х (растворимость) = 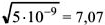
Пример оформления задачи №21
Определить произведение растворимости 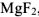 , если его растворимость в воде при 25°С равна
, если его растворимость в воде при 25°С равна 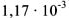 моль/л.
моль/л.
Решение:
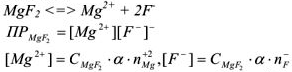
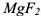 — сильный электролит,
— сильный электролит, 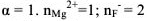
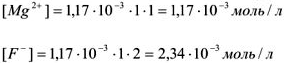
тогда 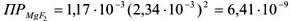
Произведение растворимости можно определить и следующим образом (пример 3):
Пример оформления задачи №22
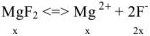
Решение:
Обозначим растворимость через х (моль/л), тогда в насыщенном растворе 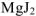 : содержится х моль/л ионов
: содержится х моль/л ионов 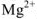 и 2 х моль/л ионов
и 2 х моль/л ионов 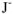
Отсюда 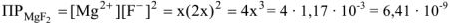
Чем меньше величина ПР. тем в меньшей степени осуществляется переход вещества в раствор, т.е тем труднее данная соль растворима.
Зная растворимость соли можно определит ПР. а исходя из ПР можно вычислить концентрацию ионов соли в насыщенном растворе, т.е. растворимость.
Так как ПР есть величина постоянная для данного малорастворимого электролита при заданной температуре, то увеличение концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион), приводит к тому что произведение концентраций ионов электролитов становится больше ПР и тогда равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентрации ионов малорастворимого электролита над его произведением растворимости. В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменится. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР.
Пример оформления задачи №23
Во сколько раз растворимость хлорида серебра 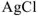 в 0,1 М растворе хлорида натрия меньше, чем в воде.
в 0,1 М растворе хлорида натрия меньше, чем в воде.
Диссоциацию 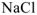 на ионы считать полной.
на ионы считать полной.
Решение:
Вычислим растворимость 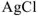 в воде. Для этого обозначим концентрацию соли
в воде. Для этого обозначим концентрацию соли 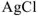 в насыщенном растворе через х (моль/л). Тогда
в насыщенном растворе через х (моль/л). Тогда
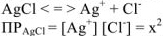
Используя значение 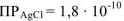 из табл. определяем
из табл. определяем
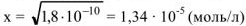
Определяем растворимость этой же соли в 0,1 М растворе 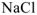
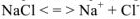
Концентрация ионов 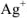 в насыщенном растворе соли будет равна х:
в насыщенном растворе соли будет равна х:
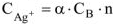 , а концентрация ионов хлора составит
, а концентрация ионов хлора составит 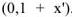 . Т.к.
. Т.к. 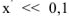 величиной х по сравнению с 0,1 можно пренебречь и считать, что
величиной х по сравнению с 0,1 можно пренебречь и считать, что 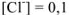 моль/л.
моль/л.
Тогда 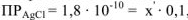 , откуда
, откуда
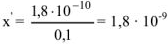
Следовательно в присутствии 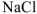 растворимость
растворимость 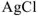 уменьшилась
уменьшилась
Напротив, если в насыщенном растворе электролита уменьшить концентрации одного из ионов (например, связав его каким-либо другим ионом), то произведение концентраций ионов будет меньше значения ПР и раствор станет ненасыщенным, равновесие между жидкой фазой и осадком сместится в сторону растворения осадка.
Таким образом, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР.
Пример оформления задачи №24
Смешали 100 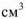 0,01 М раствора хлорида кальция и 200
0,01 М раствора хлорида кальция и 200 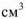 0,02 М раствора карбоната натрия. Образуется ли осадок?
0,02 М раствора карбоната натрия. Образуется ли осадок?
Решение:
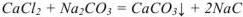
Осадок 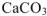 будет образовываться только в том случае, если
будет образовываться только в том случае, если
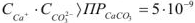
Поскольку смешивается 100 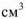 раствора
раствора 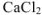 и 200
и 200 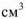 раствора
раствора 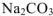 , то объем полученного раствора составляет 300
, то объем полученного раствора составляет 300 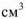 . Тогда объем раствора
. Тогда объем раствора 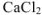 от общего объема смеси составляет 1/3, а объем раствора
от общего объема смеси составляет 1/3, а объем раствора 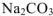 от общего объема смеси составляет 2/3, тогда
от общего объема смеси составляет 2/3, тогда
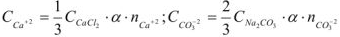
 — сильные электролиты, а = 1.
— сильные электролиты, а = 1.
Процесс диссоциации 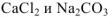 протекает по следующим схемам:
протекает по следующим схемам:
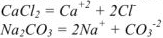
тогда 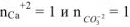
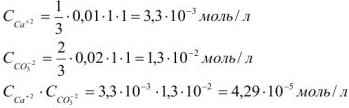
Так как 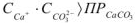 , то осадок
, то осадок 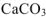 образуется.
образуется.
Так как ПР = const при данной температуре, то введение одноименного иона в систему раствор  осадок будет смещать равновесие в сторону выпадения осадка. Эту закономерность используют в тех случаях, когда требуется возможно более полное выделение из раствора малорастворимой соли. Например при очистке сточных вод, в которых содержатся токсичные ионы
осадок будет смещать равновесие в сторону выпадения осадка. Эту закономерность используют в тех случаях, когда требуется возможно более полное выделение из раствора малорастворимой соли. Например при очистке сточных вод, в которых содержатся токсичные ионы 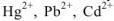 и др. Их можно вывести в виде их малорастворимых солей, например сульфатов:
и др. Их можно вывести в виде их малорастворимых солей, например сульфатов:
Зная
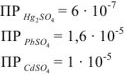
Например, увеличивая концентрацию сульфат ионов, можно превысить числовые значения ПР сульфатов ртути (I), свинца (II). кадмия и токсичные соли выпадут в осадок и тогда сточные воды очистятся от перечисленных вредных ионов.
Растворимость малорастворимых электролитов зависит не только от избыточного содержания в растворе одного из ионов (одноименные ионы), но также и от содержания других «посторонних ионов». Например, в присутствии 1 моль/л 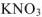 растворимость
растворимость 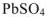 увеличится в 14 раз. а присутствии 1 моль/л
увеличится в 14 раз. а присутствии 1 моль/л 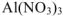 — почти в 77 раз.
— почти в 77 раз.
Причина этого явления в том, что посторонние ионы взаимодействуя своими зарядами, с основными ионами осадка удерживают их в растворе в количестве превышающем растворимость 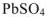 в чистом растворителе, т.е. имеет место так называемый «солевой эффект».
в чистом растворителе, т.е. имеет место так называемый «солевой эффект».
Теория электролитической диссоциации. Степень и константа диссоциации
Основы теории электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты.
Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов.
Ионное произведение воды, pH растворов. Произведение растворимости.
Ионно-молекулярные уравнения
Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами. В таких веществах переносчиками электрического тока являются заряженные частицы — ионы. При растворении в воде и в ряде неводных растворителей свойства электролитов проявляют соли, кислоты и основания. Электролитами являются также многие расплавленные соли, оксиды и гидроксиды, а также некоторые соли и оксиды в твердом состоянии.
При растворении электролитов в полярных растворителях они в различной степени распадаются на катионы и анионы. Этот процесс называется электролитической диссоциацией.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны при этом два случая. Один из них -это диссоциация растворяющихся солей, то есть кристаллов с ионной структурой, второй -диссоциация при растворении кислот, то есть веществ, состоящих из полярных молекул.
Когда кристалл соли, например, хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными (рис. 1).
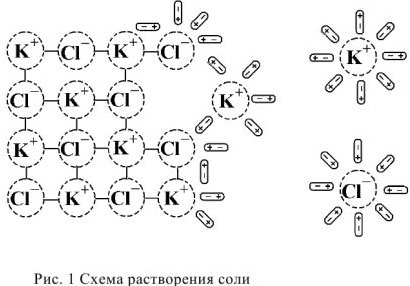
Но, если ионы притягивают к себе молекулы воды, то и молекулы воды с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
Иначе протекает диссоциация полярных молекул (рис. 2).
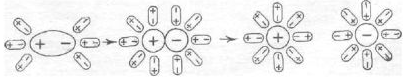
Рис. 2 Схема диссоциации полярных молекул в растворе
Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение се полюсов — поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит в конечном счете к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются. При этом ион водорода  (т.е. протон) сказывается прочно связанным с молекулой воды в ион гидроксония
(т.е. протон) сказывается прочно связанным с молекулой воды в ион гидроксония  . Так. при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:
. Так. при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:
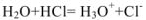
В результате этого процесса молекула 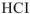 расщепляется таким образом, что общая пара электронов остается у атома хлора, который превращается в ион
расщепляется таким образом, что общая пара электронов остается у атома хлора, который превращается в ион 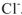 , а протон.
, а протон.
внедряясь в электронную оболочку атома кислорода в молекуле воды, образует ион гидроксония 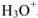 .
.
Перешедшие в раствор ноны остаются связанными с молекулами воды и образуют гидраты ионов. Иначе говоря, в результате диссоциации образуются нс свободные ионы, а соединения ионов с молекулами растворителя. В общем случае любого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а нс их гидратов или сольватов, тем более что число молекул растворителя, связанных с ионами, изменяется в зависимости от концентрации раствора и других условий.
Диссоциации веществ как ионного, так и молекулярного строения способствует полярность молекул растворителя. Поэтому не только вода, но и другие жидкости, состоящие из полярных молекул (муравьиная кислота, этиловый спирт, аммиак и другие), также являются ионизирующими растворителями: соли, кислоты и основания, растворенные в этих жидкостях, диссоциируют на ионы.
Исследуя свойства растворов солей, кислот и оснований в полярных и неполярных растворителях. Сванте Аррениус, профессор университета в Стокгольме и директор Нобелевского института, предложил теорию, получившую название теории электролитической диссоциации (ТЭД).
Основными положениями ТЭД являются:
1. Все электролиты в воде распадаются (диссоциируют) на ионы. Положительно заряженные ионы называются катионами (например, ионы водорода и металлов), отрицательно заряженные ионы называются анионами (например, ноны кислотных остатков и гидроксид-ионы).
2. Ионы отличаются от атомов по строению и свойствам.
Например, атом Na (электронная формула …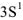 ), в отличии от иона
), в отличии от иона 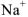 (электронная формула …
(электронная формула …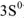 ) взаимодействует с молекулами кислорода и воды :
) взаимодействует с молекулами кислорода и воды : 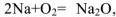 ,
, 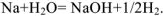
3. Движение ионов водной растворе хаотическое, но при наложении внешних электрических или магнитных полей движение ионов становится целенаправленным.
В растворах электролитов движение ионов затруднено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получивший название «ионной атмосферы».
В отсутствие внешнего электрического поля ионная атмосфера симметрична и силы, действующие на центральный ион. взаимна уравновешиваются. Если же приложить к раствору постоянное электрическое поле, то разноименно заряженные ионы будут перемещаться в противоположных направлениях. При этом каждый ион стремится двигаться в одну сторону, а окружающая его ионная атмосфера в противоположную, вследствие чего направленное перемещение иона замедляется, а следовательно, уменьшается число ионов, проходящих через раствор в единицу времени, т. е. сила тока. Чем больше концентрация раствора, тем сильнее проявляется тормозящее действие ионной атмосферы на электрическую проводимость раствора.
Аррениус обращая внимание на то, что в растворе лишь часть молекул электролита диссоциирует на ионы, ввел понятие степени диссоциации.
Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
Степень диссоциации принято обозначать греческой буквой а и выражать либо в долях единицы, либо в процентах. Так, для 0,1 н. раствора 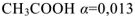 (или 1,3 %), а для 0,1 н. раствора
(или 1,3 %), а для 0,1 н. раствора 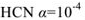 (или 0,01 %).
(или 0,01 %).
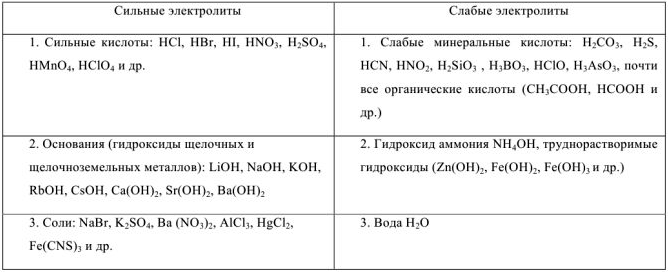
Позже было установлено, что электролиты можно разделить на 2 группы: сильные и слабые электролиты.
Сильные электролиты в водных растворах диссоциированы практически нацело, для них 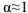 ; слабые электролиты в водных растворах диссоциируют только частично и для них
; слабые электролиты в водных растворах диссоциируют только частично и для них 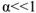 (таблица 1).
(таблица 1).
Таблица 1 — Сильные и слабые электролиты
Концентрация ионов, образующихся при диссоциации сильных и слабых электролитов рассчитывается по уравнению:
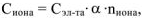
где 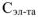 — молярная концентрация электролита, моль/л
— молярная концентрация электролита, моль/л
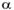 — степень диссоциации электролита, доли единицы;
— степень диссоциации электролита, доли единицы;
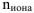 — число ионов данного вида образующихся при полной диссоциации одной молекулы электролита.
— число ионов данного вида образующихся при полной диссоциации одной молекулы электролита.
Например, вычислим концентрации ионов 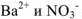 в 0.2 М растворе
в 0.2 М растворе 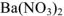 .
.
Решение:
Процесс диссоциации 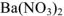 протекает по следующему уравнению:
протекает по следующему уравнению:
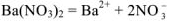
Концентрация ионов определяется по формуле: 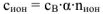 тогда
тогда
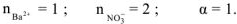 Тогда
Тогда
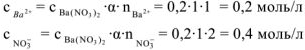
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца — до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают нс до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях.
В уравнениях обратимых реакций вместо знака равенства необходимо ставить стрелки; они символизируют протекание реакции как в прямом, так и обратном направлениях. Вначале, при смещении исходных веществ, скорость прямой реакции велика, а скорость обратной равна нулю. По мере протекания реакции исходные вещества расходуются и их концентрации падают. В результате этого уменьшается скорость прямой реакции, и их концентрация возрастает. Вследствие этого начинает идти обратная реакция, причем се скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. Так, в в последнем примере устанавливается равновесие между азотом, водородом и аммиаком.
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Если система находится в состоянии равновесия, то она будет пребывать в ней до тех пор, пока внешние условия сохраняются постоянными. Если же условия изменятся, то система выйдет из равновесия — скорости прямого и обратного процессов изменятся неодинаково — будет протекать реакция. Наибольшее значение имеют случаи нарушения равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в равновесии, давления или температуры.
Направление смещения равновесия определяется принципом Ле Шатсльс: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Действительно, при введении в систему одного из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества. При повышении давления оно смещается так, что давление в системе снижается; при повышении температуры равновесие смещается в сторону эндотермической реакции — температура в системе падает. Количественной характеристикой динамического равновесия служит константа химического равновесия.
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. В растворе слабого электролита устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
Например, диссоциация слабого электролита 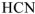 выразится уравнением:
выразится уравнением:
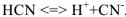
а сильного электролита 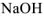 — уравнением
— уравнением 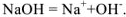
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты 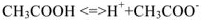 константа равновесия имеет вид
константа равновесия имеет вид
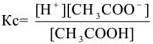
где: [В] равновесная концентрация вещества (иона): моль/л
Здесь в числителе дроби стоят концентрации ионов-продуктов диссоциации, а в знаменателе — концентрация оставшихся после диссоциации недиссоциированных молекул.
Согласно формуле (1), 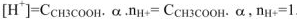 .
.

Таким образом, для слабых электролитов:
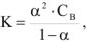
где:  — молярная концентрация электролита, моль/л;
— молярная концентрация электролита, моль/л;
 — степень диссоциации электролита, доли единицы.
— степень диссоциации электролита, доли единицы.
Для электролитов, у которых 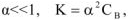
тогда 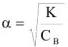 (только для слабого электролита)
(только для слабого электролита)
Это уравнение выражает закон разбавления Оствальда:
С разбавлением раствора степень диссоциации слабого электролита возрастает.
Оно дает возможность вычислять степень диссоциации при различных концентрациях слабого электролита.
Константы диссоциации слабых электролитов — величины табличные.
Пример оформления задачи №25
Вычислить степень диссоциации 0,05 М водного раствора хлорноватистой кислоты  .
.
Решение:
 — слабый электролит,
— слабый электролит, 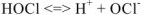
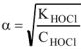 , где
, где  — константа диссоциации
— константа диссоциации 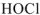 . Так как
. Так как 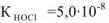 (табл.),
(табл.),
тогда 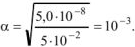
Многоосновные кислоты, а также многокислотные основания диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ноны различного заряда. Например, диссоциация слабого электролита угольной кислоты происходит в две ступени:
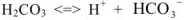 1 ступень, тогда диссоциация по первой ступени характеризуется первой константой диссоциации
1 ступень, тогда диссоциация по первой ступени характеризуется первой константой диссоциации 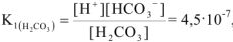
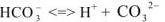 2 ступень.
2 ступень.
а диссоциация по второй ступени — второй константой диссоциации
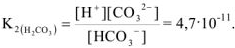
Суммарной реакции диссоциации: 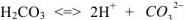 отвечает суммарная константа равновесия:
отвечает суммарная константа равновесия:
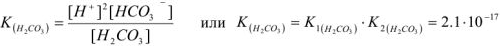
Константа диссоциации слабых электролитов по первой ступени всегда значительно больше константы диссоциации по второй ступени: 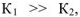 , поэтому диссоциация многоосновных кислот и многокислотных оснований — процесс равновесный и протекает обычно только по первой ступени.
, поэтому диссоциация многоосновных кислот и многокислотных оснований — процесс равновесный и протекает обычно только по первой ступени.
Например:
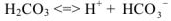
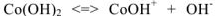 , поэтому эти соединения склонны к образованию основных и кислых солей (
, поэтому эти соединения склонны к образованию основных и кислых солей (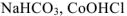 и др.).
и др.).
Сильные электролиты практически полностью диссоциируют в воде, поэтому для них обычно записывают суммарные уравнения диссоциации. Например:
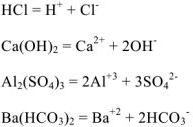
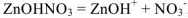 , однако для сильного электролита серной кислоты диссоциация рассматривается по двум ступеням
, однако для сильного электролита серной кислоты диссоциация рассматривается по двум ступеням
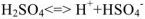 -1 ступень,
-1 ступень,
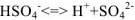 — 2 ступень.
— 2 ступень.
В реальных растворах возможно взаимодействие между акватированными ионами с образованием ассоциатов, или объединений, состоящих из двух и более частиц (рис. 3).
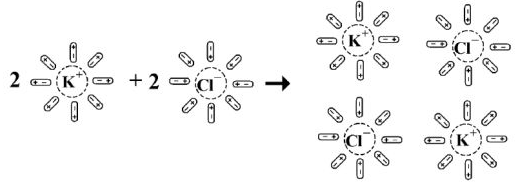
Рис. 3 Схема образования ассоциатов в растворе
Для характеристики этого процесса понятие концентрации ионов заменяется понятием активности ионов.
Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях. Активность иона а равна его концентрации  , умноженной на коэффициент активности
, умноженной на коэффициент активности  :
:
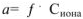
Коэффициенты активности различных ионов различны. Кроме того, они изменяются при изменении условий, в частности при изменении концентрации раствора. В концентрированных растворах коэффициент активности обычно меньше единицы, а с разбавлением раствора он приближается к единице. Значение f, меньшее единицы, указывает на взаимодействие между ионами, приводящее к их взаимному связыванию. Если же коэффициент активности близок к единице, то это свидетельствует о слабом межионном взаимодействии. Действительно, в очень разбавленных растворах средние расстояния ионов друг от друга настолько велики, что действие межионных сил почти не проявляется.
Коэффициент активности данного нона зависит только от его заряда и от ионной силы раствора I, под которой понимают полусумму произведений концентраций всех находящихся в растворе ионов Ci на квадрат их заряда 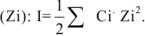
Пример оформления задачи №26
Вычислить активность ионов в растворе, содержащем 0,05 моль/л нитрата кальция и 0,2 моль/л хлорида натрия.
Решение:
Активность ионов в растворе сильных электролитов определяется по формуле:
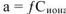
Процессы диссоциации 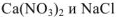 протекают по следующим уравнениям:
протекают по следующим уравнениям:
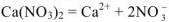
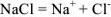
Концентрация ионов определяется по формуле: 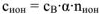 . тогда
. тогда
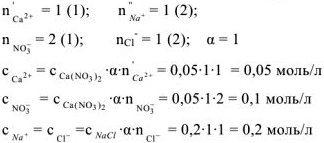
Ионная сила раствора равна:
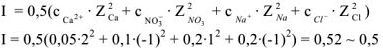
Коэффициент активности ионов определяем из таблицы:
Коэффициенты активности ионов  при различных ионных силах раствора
при различных ионных силах раствора
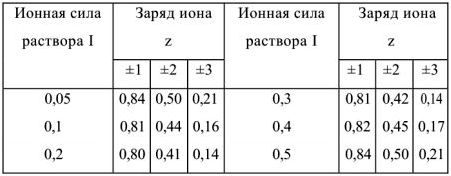
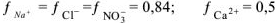
Тогда активность ионов
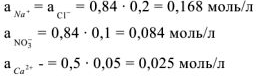
Законы Рауля и Ванг-Гоффа для электролитов. Изотопический коэффициент
Все свойства раствора сильного электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует его полной диссоциации электролита.
В связи с этим, определяемое по электрической проводимости (или другими методами) значение степени диссоциации сильных электролитов называется кажущейся степенью диссоциации  .
.
Отношение числа ионных частиц в растворе электролита, полученное по данным электропроводности и меньшее их истинного значения, к общему числу молекул электролита, введенных в раствор, называется изотоническим коэффициентом и обозначается i:
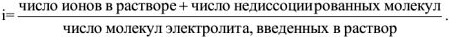
Изотонический коэффициент связан с кажущейся степенью диссоциации сильного электролита соотношением:
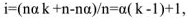
где 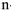 — число молекул электролита, введенных в раствор;
— число молекул электролита, введенных в раствор;
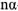 — число молекул в растворе, которые продиссоциировали на ионы;
— число молекул в растворе, которые продиссоциировали на ионы;
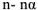 — число оставшихся нелиссоциированных молекул (или число ассоциатов); пак-число ионов в растворе.
— число оставшихся нелиссоциированных молекул (или число ассоциатов); пак-число ионов в растворе.
Отсюда 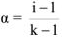
где k — суммарное число ионов, на которые диссоциирует одна молекула электролита. Для 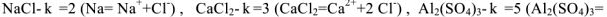
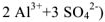 и т.д.
и т.д.
Аррениус обратил внимание на тесную связь между способностью растворов солей, кислот и оснований проводить электрический ток и отклонениями растворов этих веществ от законов Вант-Гоффа и Рауля. Он показал, что по электрической проводимости раствора можно рассчитать его осмотическое давление, а следовательно, и поправочный коэффициент i. Значения i, вычисленные им из электрической проводимости хорошо совпали с величинами, найденными для тех же растворов иными методами.
Причиной чрезмерно высокого осмотического давления растворов электролитов является, согласно Аррениусу, диссоциация электролитов на ионы. Вследствие этого, с одной стороны, увеличивается общее число частиц в растворе, а следовательно, возрастают осмотическое давление, понижение давления пара и изменения температур кипения и замерзания, с другой, — ионы обусловливают способность раствора проводить электрический ток.
Поскольку физико-химические свойства растворов зависят от концентрации частиц растворенного вещества, в расчетные формулы физико-химических свойств электролитов вводится изотонический коэффициент, позволяющий учесть диссоциацию молекул.
Законы Рауля и Ванг-Гоффа для неэлектролитов и электролитов.

где все обозначения для электролитов аналогичны обозначениям для неэлектролитов.
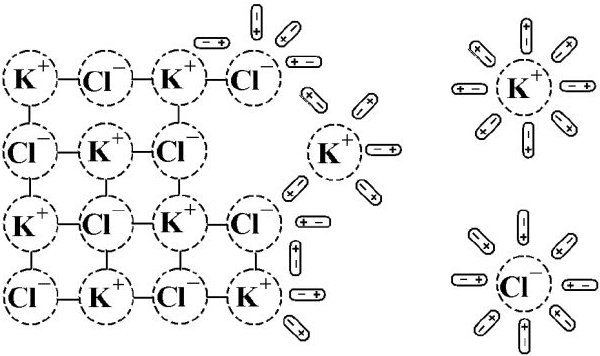
Структура воды. Физические и химические свойства. Диаграмма состояния
Молекула воды имеет угловое строение, входящие в ее состав атомы образуют равнобедренный треугольник, в основании которого находятся два атома водорода, а в вершине — атом кислорода.
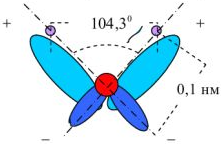
Из восьми электронов, составляющих электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи О — Н и остальные четыре электрона представляют собой две не поделенные электронные пары. Электроны, образующие связи О — Н, смещены к атому кислорода как более электроотрицательному элементу. В результате этого атомы водорода приобретают эффективный положительный заряд (положительный полюс), а две пары не поделенных ё атома кислорода образуют отрицательный полюс, т.е. молекула воды представляет собой диполь.
В жидкой воде благодаря образованию водородных связей происходит ассоциация молекул. В твердой фазе ( лед ) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами согласно схеме:
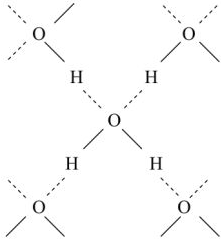
Образование водородных связей приводит к расположению молекул воды, когда они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной из соседнего слоя.
Структура льда принадлежит к наименее плотным структурам, в ней существует пустоты, размеры которых превышают размеры молекулы воды.
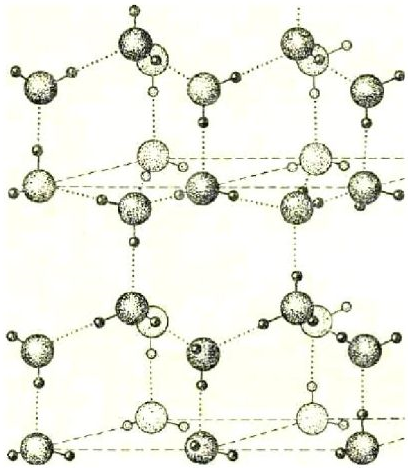
Дополнительная теория:
- Физические свойства воды в химии
- Химические свойства воды в химии
- Методы умягчения воды в химии
- Диаграмма состояния воды в химии
Физико-химические свойства растворов неэлектролитов
Общая характеристика pacтворов
Неэлектролиты — это вещества водные растворы и расплавы, которых не проводят электрический ток.
При растворении молекулы растворенного вещества и растворителя взаимодействуют, друг с другом взаимно изменяют свои свойства.
Между молекулами растворителя и растворенного вещества возможны следующие взаимодействия:
- различные по силе межмолекулярные взаимодействия;
- ассоциация молекул растворенного вещества под действием растворителя;
- диссоциация молекул растворенного вещества на более простые молекулы;
- взаимодействие молекул ( двух и более ) растворенных веществ под влиянием растворителя.
Свойства растворов зависящие от концентрации и практически не зависящие от природы растворенного вещества называются коллигативными (коллективными). К ним относятся:
- понижение давления насыщенного пара растворителя над раствором;
- повышение температуры кипения и понижение температуры замерзания раствора;
- повышение осмотического давления раствора.
Эти свойства проявляются в полной мере в идеальных растворах.
Идеальным называют раствор, в котором не происходит химического взаимодействия между компонентами, а силы межмолекулярного взаимодействия — равны. Образование таких растворов сопровождается нулевым тепловым эффектом (дн“ = 0) и каждый компонент ведет себя в растворе независимо от других компонентов. По своим свойствам к идеальным растворам приближаются разбавленные растворы неэлектролитов.
Дополнительная теория:
Пример оформления задачи №27
Раствор, в 100  которого содержится 2,3 г неэлектролита, обладает при 298К осмотическим давлением, равным 618,5 кПа. Определить молярную массу неэлектролита.
которого содержится 2,3 г неэлектролита, обладает при 298К осмотическим давлением, равным 618,5 кПа. Определить молярную массу неэлектролита.
Решение:
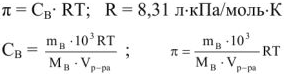
отсюда
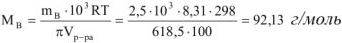
Ответ: Молярная масса растворенного вещества равна 92,13 г/моль.
Гальванические элементы. Коррозия металлов
- Реакции окисления-восстановления. Метод электронного баланса.
- Электродный потенциал, его измерение, стандартный электродный потенциал.
- Ряд стандартных потенциалов металлических электродов. Зависимость значения электродного потенциала от концентрации и pH электролита.
- Гальванические элементы (ГЭ), напряжение ГЭ. Современные ГЭ.
- Аккумуляторы (щелочные и кислотные). Материалы анода и катода. Процессы, протекающие при зарядке и разрядке аккумуляторов.
- Химическая коррозия металлов.
- Электрохимическая коррозия металлов.
- Показатели коррозии (весовой, объемный и глубинный).
- Методы защиты металлов от коррозии.
Существуют два типа химических реакций:
Реакции, в которых не изменяется степень окисления элементов:
Реакции присоединения
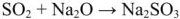
Реакции разложения
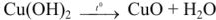
Реакции обмена
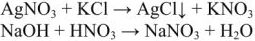
Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений:
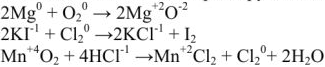
Такие реакции называются окислительно-восстановительными.
Реакции, сопровождающиеся изменением степеней окисления элементов в молекулах реагирующих веществ, называются окислительно-восстановительными.
Окислительно-восстановительные реакции играют важную роль в природе (фотосинтез) и технике. К окислительно-восстановительным реакциям относятся: процессы горения топлива, протекающие в топках котлов тепловых электростанций, в двигателях внутреннего сгорания и реактивных двигателях ракет, нанесение металлических покрытий на металлические и неметаллические изделия. Химическое никелирование, меднение, золочение, палладирование широко используется в электронной и вычислительной технике, электротехнике, для получения печатных схем.
При изготовлении печатных плат производят избирательное травление (окисление) пленки меди, нанесенной на полимер. В качестве окислителя служит хлорид железа (III). 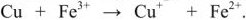 . Остающаяся на поверхности полимера медь образует полосы определенной конфигурации.
. Остающаяся на поверхности полимера медь образует полосы определенной конфигурации.
Степень окисления
Степень окисления — это условный заряд атома в молекуле, вычисленный из предположения, что молекула состоит из ионов и в целом электронейтральна. Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью — положительные.
Расчет степени окисления. Для вычисления степени окисления элемента следует учитывать следующие положения:
- Степени окисления атомов в простых веществах равны нулю (
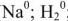
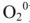 ).
). - Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов
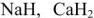 и др., где степень окисления водорода -1), кислорода (-2) (кроме
и др., где степень окисления водорода -1), кислорода (-2) (кроме 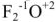 и пероксидов, содержащих группу -О-О-, в которой степень окисления кислорода (-1).
и пероксидов, содержащих группу -О-О-, в которой степень окисления кислорода (-1). - Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы. Примеры:
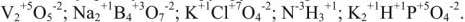
- Степень окисления элемента в виде одноименного иона в соединении, имеющем ионное строение, равна заряду данного иона.
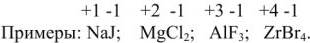
5. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
Пример оформления задачи №28
Рассчитать степень окисления азота в соединениях 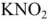 и
и 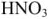 .
.
Решение:
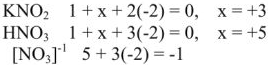
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Атомы или ионы, которые отдают электроны — восстановители. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями. Процесс присоединения электронов — восстановление: При восстановлении степень окисления понижается:
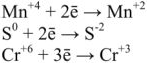
Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому что внешний энергетический уровень у таких атомов завершен 8 электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов — (n-8) (где n — номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
Важнейшие окислители и восстановители
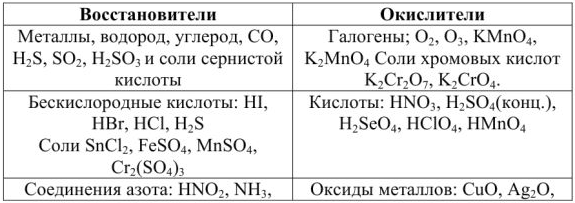
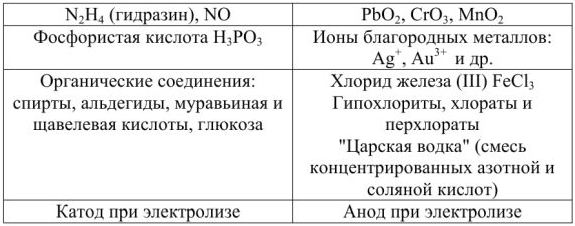
Составление уравнений окислительно-восстановительных реакций
Электронный баланс — метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
- Записать схему реакции.
- Проставить степени окисления над знаками элементов.
- Выделить элементы, изменяющие степени окисления и определить число электронов, приобретенных окислителем и отдаваемых восстановителем.
- Составить уравнения электронного баланса. Найти наименьшее общее кратное (НОК) и дополнительные множители (ДМ). Сложить уравнения процессов окисления и восстановления, предварительно умноженные на дополнительные множители.
- Коэффициенты перед окислителем и восстановителем перенести в молекулярное уравнение. Проверить, расходуется ли окислитель или восстановитель на процессы , не связанные с окислением и восстановлением. Подобрать коэффициенты для всех остальных участников реакции.
- Уравнять атомы водорода и кислорода.
Пример оформления задачи №29
Расставить коэффициенты в уравнении
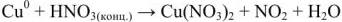
Решение:
1. Проставить степени окисления над элементами, атомы которых их изменяют
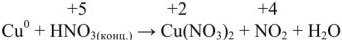
2. Составить уравнения электронного баланса. Определить число электронов, отдаваемых восстановителем и принимаемых окислителем
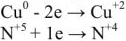
4. Найти наименьшее общее кратное (НОК) между числом отданных и принятых электронов. Определить дополнительные множители.
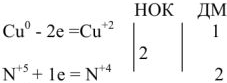
4. Сложить уравнения процессов окисления и восстановления, предварительно умноженные на дополнительные множители.

5. Коэффициенты, стоящие перед восстановителем и окислителем перенести в молекулярное уравнение. Проверить расходуется ли азотная кислота на другие процессы, не связанные с окислением и восстановлением.
 расходуется на получение 1 моль
расходуется на получение 1 моль 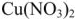

6. Сложить молекулы азотной кислоты и уравнять атомы водорода и кислорода.
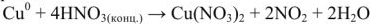
Молярная масса эквивалента окислителя и восстановителя
В окислительно-восстановительных реакциях окислитель и восстановитель реагируют друг с другом в эквивалентных количествах. Эквивалентом окислителя или восстановителя называется некоторая реальная или условная частица, которая может присоединять или отдавать один электрон в окислительно-восстановительной реакции. Молярная масса эквивалента окислителя и восстановителя равна молярной массе окислителя, деленной на число электронов, принятых в данной реакции одной молекулой окислителя. Молярная масса эквивалента восстановителя равна молярной массе восстановителя деленной на число электронов, отданных одной молекулой восстановителя.
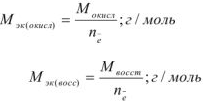
где 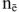 — число принятых электронов одной молекулой окислителя или число электронов, отданных одной молекулой восстановителя.
— число принятых электронов одной молекулой окислителя или число электронов, отданных одной молекулой восстановителя.
Например, при протекании реакции:
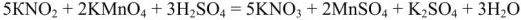
в кислой среде 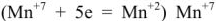 присоединяет 5 электронов, поэтому
присоединяет 5 электронов, поэтому 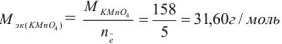
в нейтральной среде 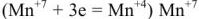 присоединяет 3 электрона, поэтому
присоединяет 3 электрона, поэтому 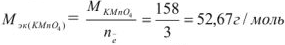
в щелочной среде 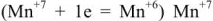 присоединяет 1 электрон, поэтому
присоединяет 1 электрон, поэтому 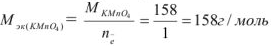
Электродный потенциал, его измерение
Если металлическую пластину погрузить в воду, то из слоя металла, находящегося на границе с водой, положительные ионы металла начнут переходить в воду. При этом в кристаллической решетке металла окажется избыток электронов и пластина приобретет отрицательный заряд, а раствор, примыкающий к поверхности металлической пластины, — положительный заряд.
При контакте металла с водным растором происходит гидратация ионов металла, находящихся на поверхности. Возникают силы притяжения между диполями воды и положительными ионами металла, что ослабляет связь последних с электронами в кристаллической решетке металла и приводит к освобождению части ионов из металлической решетки
Таким образом, вследствие гидратации происходит частичное разделение ионов металла и электронов между раствором и металлом:
При этом металл разрушается или растворяется с поверхности и одновременно приобретает заряд.
По мере перехода гидратированных ионов в раствор и накопления избыточных электронов в металле увеличивается скорость обратного процесса -перехода металлических ионов из раствора в кристаллическую решетку с возобновлением их связи с электронами. Когда скорости прямого и обратного процессов становятся равными, наступает динамическое равновесие:
Это же равновесие можно изобразить в форме более удобной для определения факторов, смещающих равновесие:
на границе в растворе в металле
металл-раствор
Гидратированные ионы металла в растворе преимущественно остаются удержанными около поверхности металла, приобретающего отрицательный заряд. Таким образом, на границе металл-раствор образуется равновесный двойной электрический слой (рис. 1), т.е. между металлом и раствором возникает скачок потенциала, определяющий электродный потенциал металла. Величина электродного потенциала металла, опущенного в воду, зависит от ряда факторов, но прежде всего от химической природы металла, структуры его кристаллической решетки и степени гидратации его ионов.

При погружении металла в раствор его соли также возникает двойной электрический слой, но в этом случае возможны два механизма его образования. Если концентрация катионов металла в растворе велика или металл достаточно активный, вследствие чего равновесие процесса сдвинуто вправо, то металлическая пластинка заряжается отрицательно. В том случае, когда равновесная концентрация катионов металла в растворе мала или металл малоактивный, равновесие процесса сдвигается влево и металлическая пластинка заряжается положительно, а раствор за счет анионов  -отрицательно (рис. 2).
-отрицательно (рис. 2).
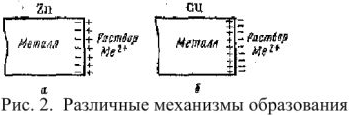
двойного электрического слоя при погружении металла в раствор собственной соли
В любом случае на границе раздела двух фаз образуется двойной электрический слой. Разность (скачок) потенциалов, возникающая между металлом и жидкой фазой, называется электродным потенциалом 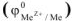 . Потенциалу металла приписывается тот знак, который возникает на его поверхности в двойном электрическом слое.
. Потенциалу металла приписывается тот знак, который возникает на его поверхности в двойном электрическом слое.
Пластинка металла и раствор его соли (т.е. катионы этого металла) вместе составляют единую окислительно-восстановительную систему, характеризующуюся определенным электродным потенциалом, который зависит от природы металла, концентрации его ионов в растворе, от температуры и pH среды. Экспериментально определить абсолютное значение электродного потенциала невозможно. Поэтому на практике измеряется разность потенциалов между электродным потенциалом исследуемой системы и потенциалом электрода сравнения. В принципе в качестве электрода сравнения может служить любой электрод в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости, постоянства во времени всех характеристик и относительной простоты изготовления. Для водных электролитов наиболее часто применяют в качестве электрода сравнения водородный, каломельный, галогеносеребряные, оксидно-ртутный и хингидронный электроды. Водородный электрод, изготавливается из губчатой платины, погруженной в раствор  с активностью ионов водорода, равной единице (что соответствует примерно их концентрации, равной 1 моль/л). Через раствор при 298 К (25°С) под давлением 101,325 кПа пропускается газообразный водород (рис. 3), который поглащастся платиной. Таким образом, поверхность платинового электрода фактически насыщена водородом.
с активностью ионов водорода, равной единице (что соответствует примерно их концентрации, равной 1 моль/л). Через раствор при 298 К (25°С) под давлением 101,325 кПа пропускается газообразный водород (рис. 3), который поглащастся платиной. Таким образом, поверхность платинового электрода фактически насыщена водородом.
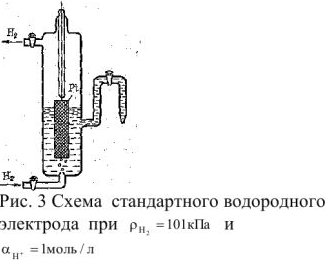
Молекула водорода в состоянии в этом состоянии распадается на атомы, которые ионизируются 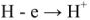
Ионы 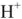 переходят в раствор подобно ионами металла. Одновременно ионы
переходят в раствор подобно ионами металла. Одновременно ионы  из раствора, находящиеся у поверхности платины принимают электроны
из раствора, находящиеся у поверхности платины принимают электроны 
Между этими процессами устанавливается равновесие, которое в упрощенной форме можно описать уравнением:
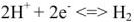
раствор тверда фаза
Это равновесие характеризуется определенным значением скачка потенциала на межфазной границе. Электродный потенциал, отвечающий данным условиям, получил название стандартного электродного потенциала , а его численное значение условно принято равным нулю.
Соединив электрод, представляющий исследуемую окислительно-восстанови-тельную систему, со стандартным водородным электродом, определяют электродный потенциал данной системы.
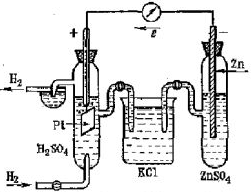
Рис. 4. Схема измерения стандартного электродного потенциала относительно водородного электрода
При этом протекают следующие процессы:
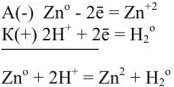
Для того, чтобы можно было сравнивать окислительно-восстановительные свойства различных металлов по их электродным потенциалам, необходимо, чтобы последние также были измерены при стандартных условиях. Таковыми обычно являются концентрация ионов  , равная 1 моль/л и температура 298 К. Потенциалы, измеренные в таких условиях носят название стандартных электродных потенциалов металлов и обозначаются через
, равная 1 моль/л и температура 298 К. Потенциалы, измеренные в таких условиях носят название стандартных электродных потенциалов металлов и обозначаются через  .
.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, составляют их электрохимический ряд напряжений металлов (табл. 1).
Таблица 1
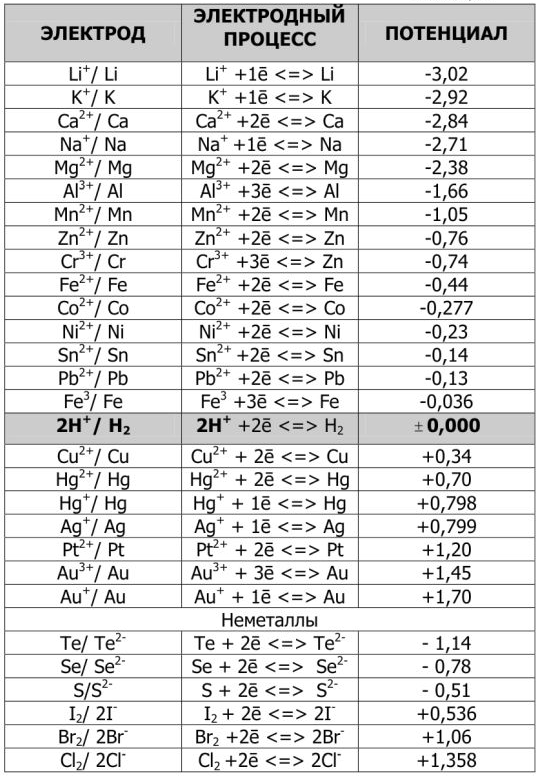
Ряд напряжений характеризуют следующие химические свойства
1. Чем меньше значение стандартного электродного потенциала металла  тем более сильными восстановителями являются его ионы в низшей степени окисления.
тем более сильными восстановителями являются его ионы в низшей степени окисления.
2. Чем больше значение  , тем более сильным окислителем являются ионы в высшей степени окисления.
, тем более сильным окислителем являются ионы в высшей степени окисления.
3. Металлы, имеющие отрицательные значения  , т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот.
, т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот.
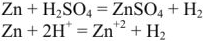
4. Металлы, имеющие положительное значение 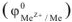 , т.е. стоящие в ряду напряжений правее водорода, не способны вытеснять его из разбавленных кислот.
, т.е. стоящие в ряду напряжений правее водорода, не способны вытеснять его из разбавленных кислот.
5. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокое значение 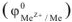 .
.
Приведенные в табл. 1 значения 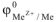 относятся только к концентрациям ионов металлов
относятся только к концентрациям ионов металлов 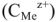 равным 1 моль/л при температуре 298 К (25°С). При измерении этих условий изменяется величина, а иногда и знак электродного потенциала
равным 1 моль/л при температуре 298 К (25°С). При измерении этих условий изменяется величина, а иногда и знак электродного потенциала 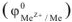 .
.
Дополнительная теория:
- Гальванический элемент в химии
- Зависимость величины электродного потенциала от концентрации ионов и температуры в химии
Пример оформления задачи №30
Алюминиевый электрод погружен в 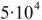 М раствор сульфата алюминия. Вычислить значение электродного потенциала алюминия.
М раствор сульфата алюминия. Вычислить значение электродного потенциала алюминия.
Решение:

По таблице [ 1 ] определяем стандартный электродный потенциал алюминия
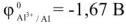
Записываем уравнение электродного процесса, протекающего на поверхности алюминиевого электрода в растворе своей соли:
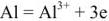
z — число электронов, участвующих в электродном процессе.
Для данной реакции z равно заряду иона алюминия 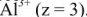 . Рассчитываем концентрацию ионов алюминия в растворе
. Рассчитываем концентрацию ионов алюминия в растворе 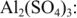
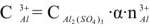
Разбавленный раствор 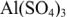 — сильный электролит. Следовательно, а —
— сильный электролит. Следовательно, а —
1. По уравнению диссоциации
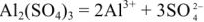
число ионов 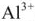 , образующихся при диссоциации одной молекулы
, образующихся при диссоциации одной молекулы 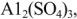 , равно 2. Следовательно,
, равно 2. Следовательно, 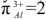 .
.
Тогда 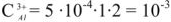 моль/л.
моль/л.
Рассчитываем электродный потенциал алюминиевого электрода по уравнению Нернста
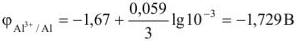
Ответ: 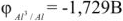 .
.
Пример оформления задачи №31
Потенциал цинкового электрода, погруженного в раствор своей соли равен (-0,86 В). Вычислить концентрацию ионов цинка в растворе.

По таблице 9 [1] определяем стандартный электродный потенциал цинка 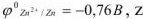 равно заряду иона цинка
равно заряду иона цинка 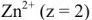
Тогда 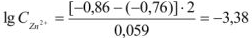
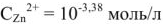
Ответ: 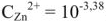 моль/л.
моль/л.
В случае водородного электрода на платине имеет место равновесие:
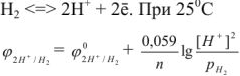
Но так как 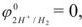 , то
, то
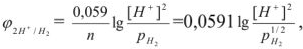
а при давлении водорода, равном 1 атм,
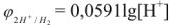
Так как 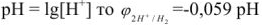
Например:
в нейтральной среде 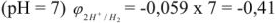 в
в
в кислой среде 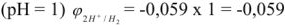 в
в
в щелочной среде 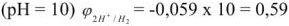 в
в
Коррозия и защита металлов
Введение
Коррозией называется процесс самопроизвольного разрушения металлов под действием окружающей среды. При этом металл из свободного состояния переходит в химически связанное.
Большинство металлов в свободном состоянии является термодинамически нестабильными и способны под действием окислителей самопроизвольно» окисляться. Для большинства металлов при окислении их по схеме
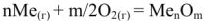
изменение энергии Гиббса отрицательно,  .
.
Например,
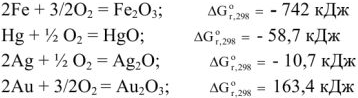
Следовательно., даже малоактивные металлы способны самопроизвольно окисляться кислородом воздухе. И только золото устойчиво против окисления кислородом. Поэтому почти все металла могут подвергаться коррозии. Борьба с коррозией является включительно важной проблемой. Установлено, что ежегодно за счет коррозии разрушается до 15-20% годового производства железа. При этом безвозвратное потери от рассеивания продуктов коррозии достигают 5-6%. Остальное количество металла возвращается на .переработку в металлургический передел. Для замедления процессов коррозии и снижения потерь металлов широко используются различные методы защиты металлов от коррозии.
Процесс коррозии может быть представлен в виде двух сопряженных процессов;
окисление металла 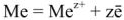
восстановление
окислителя 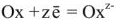
суммарный промесс 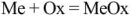
В установившемся режиме скорость процесса окисления металла  равна скорости процесса восстановления окислителя
равна скорости процесса восстановления окислителя 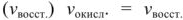 Поэтому снижение скорости любого процесса (окисления или восстановления) приводит к замедлению суммарного коррозионного процесса.
Поэтому снижение скорости любого процесса (окисления или восстановления) приводит к замедлению суммарного коррозионного процесса.
Дополнительная теория:
- Классификация коррозионных процессов в химии
- Скорость коррозии и ее характеристика в химии
- Химическая коррозия в химии
- Электрохимическая коррозия в химии
- Коррозия металлов с кислородной деполяризацией в химии
Пример оформления задачи №32
Рассчитать весовой и глубинный показатели коррозии алюминия в концентрированной серной кислоте и произвести количественную оценку стойкости алюминия, если образец размером a*b*c = 50 * 30 * I мм до испытания имел массу 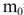 = 4,053 г, после восьмисуточного испытания
= 4,053 г, после восьмисуточного испытания 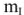 = 4,0189 г. Плотность алюминия
= 4,0189 г. Плотность алюминия 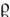 = 2,7 г/
= 2,7 г/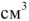 .
.
Решение:
Рассчитываем весовой показатель коррозии К по уравнению (3)
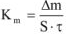
Изменение массы образца при коррозии
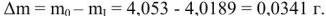
Полная поверхность образца
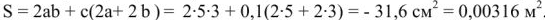
Время коррозии
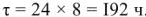
Тогда:
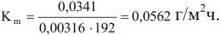
2. Рассчитываем глубинный показатель коррозии по уравнению (6)
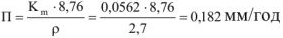
В соответствии с таблицей коррозионной стойкости (ГОСТ 13819-68) образец алюминия относится к пониженной группе стойкости (балл 6) по десятибалльной шкале.
Пример оформления задачи №33
Рассчитать весовой, объемный и токовый показателя при равномерной коррозии железе, если в соляной кислоте глубинный показатель коррозии равен П = 0,1 мм/год. Плотность железа 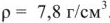 .
.
Решение:
1. В соответствии с уравнением (6) определяем весовой показатель коррозии 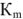
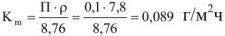
2. Объемный показатель коррозии 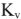 рассчитываем по уравнению (5) —
рассчитываем по уравнению (5) —
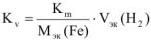
Учитывая, что коррозия железа в соляной кислоте будет протекать по уравнению
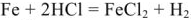
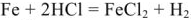 , молярная масса эквивалента железа в этой реакции будет равна.
, молярная масса эквивалента железа в этой реакции будет равна.
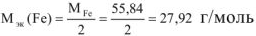
Эквивалентной объем водорода 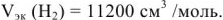
Тогда
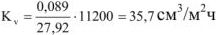
Пример оформления задачи №34
Составить схему коррозии технического железа в серной кислоте в отсутствии кислорода (рис. 10).
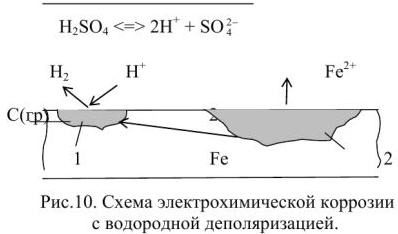
Решение:
На поверхности технического железа имеются участки, на которых находятся вкрапления углерода. Вкрапления углерода менее активны, чем участки железа, и поэтому, являются катодными участками (1). Участки железа являются анодными участками (2). Следовательно, в растворе серной кислоты на поверхности железа образуются короткозамкнутые гальванические элементы, схему которой можно записать в виде:
При работе такого элемента на анодных участках происходит окисление железа:
Ионы железа будут переходить в раствор. Железо начнет разрушаться. Электроны будут перетекать от анодных участков к катодным, поляризуя их
отрицательно. На катодных участках, будет происходить восстановление окислителя — ионов водорода — деполяризация катодных участков.
Суммарное уравнение реакции электрохимической коррозии будет иметь вид:
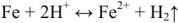
В молекулярной форме
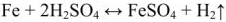
Уравнение электрохимической коррозии аналогично уравнению растворения железа в серной кислоте. Однако принципиальное различие будет заключаться в том, что при электрохимической коррозии процессы окисления и восстановления пространственно разделены.
Пример оформления задачи №35
Составить схему коррозии железа, частично покрытого оловом, погруженного в воду (рн = 7), находящуюся в контакте с воздухом (рис. 11).
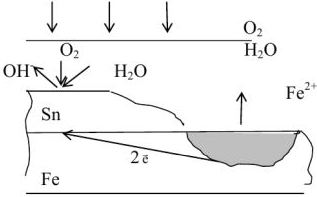
Рис. 11. Схема электрохимической коррозии с кислородной деполяризации в нейтральной среде.
Решение:
При контакте железа с оловом образуется короткозамкнутый гальванический элемент, в котором железо, как более активный металл (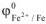 = — 0,44 В), будет являться анодом, а олово, как менее активный металл (
= — 0,44 В), будет являться анодом, а олово, как менее активный металл (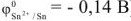 ) будет являться катодом. Электролитом является вода. Схему коррозионного гальванического элемента можно записать в виде
) будет являться катодом. Электролитом является вода. Схему коррозионного гальванического элемента можно записать в виде
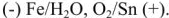 . Тогда на аноде будет происходить
. Тогда на аноде будет происходить
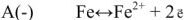
На катоде будет происходить восстановления кислорода по схеме:
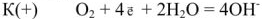
Суммарное уравнение коррозионного процесса будет иметь вид:
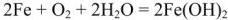
Следовательно, коррозии будет подвергаться более активный металл (железо), а на поверхности менее активного металла (олово), будет происходить восстановление кислорода.
Возможно эти страницы вам будут полезны:

