Оглавление:
Соли. Классификация. Свойства. Номенклатура
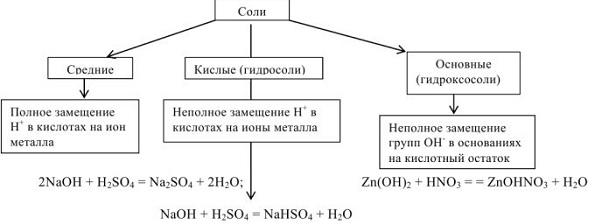
Соли — сложные вещества, которые являются продуктами полного или частичного замещения ионов водорода кислоты ионами металла или гидроксид ионов основания кислотными остатками.
Соли в водных растворах диссоциируют на катионы металлов или другие, более сложные катионы: 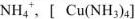 и кислотные остатки. Соли подразделяются на следующие типы:
и кислотные остатки. Соли подразделяются на следующие типы:
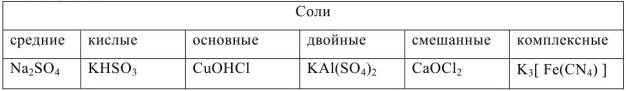
Комплексные соли — соли, имеющие сложные катионы или анионы, в которых связь образована по донорно-акцепторному механизму ( например: 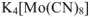 ).
).
Двойными называют соли, образованные разными катионами и одним и тем же анионом: 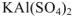 — сульфат калия-алюминия. Двойные соли
— сульфат калия-алюминия. Двойные соли 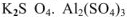 или
или 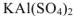 отличается от комплексной тем, что находящиеся в кристаллической решетке комплексные ионы не способны к самостоятельному существованию в растворах, где они полностью распадаются на составные части.
отличается от комплексной тем, что находящиеся в кристаллической решетке комплексные ионы не способны к самостоятельному существованию в растворах, где они полностью распадаются на составные части.
Например:
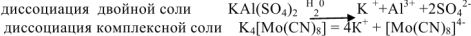
Смешанными называют соли, образованные одним и тем же катионом, но разными анионами 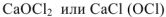 — хлорид-гипохлорид кальция.
— хлорид-гипохлорид кальция.
Одним из способов получения солей является взаимодействие кислот и оснований.

Номенклатура
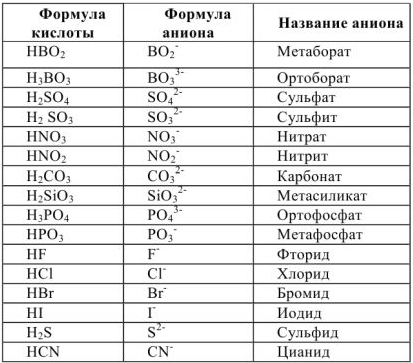
Название соли отражает название металла и латинское название кислотного остатка. Латинское название кислотного остатка происходит обычно от латинского названия элемента, образующего кислоту. При этом название соли бескислородной кислоты имеет окончание ид: 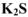 — сульфид калия;
— сульфид калия;
а кислородосодержащий кислоты — ат в случае высшей степени окисления кислотообразующего элемента: 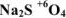 — сульфат натрия;
— сульфат натрия;
и в случае более низкой его степени окисления —ит: 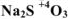 -сульфит натрия
-сульфит натрия
Для солей образованных металлами с переменной степенью окисления, степень окисления металла указывают в скобках, как в оксидах или в основаниях:
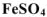 — сульфат железа (II),
— сульфат железа (II),
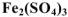
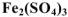 — сульфат железа (III),
— сульфат железа (III),
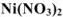 — нитрат никеля (II);
— нитрат никеля (II);
Название кислой соли имеет приставку гидро-, указывающую на наличие незамещенных атомов водорода; если таких незамещенных атомов два или больше, то их число обозначается греческими числительными (ди-, три- и т.д.).
Так, 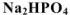 называется гидроортофосфатом натрия,
называется гидроортофосфатом натрия,
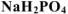 — дигидроортофосфатом натрия,
— дигидроортофосфатом натрия,
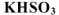 — гидросульфит калия;
— гидросульфит калия;
Основная соль характеризуется приставкой гидроксо-, указывающей на наличие незамещенных гидроксильных групп.
Например, 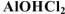 -хлорид гндроксоалюминия,
-хлорид гндроксоалюминия,
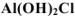 — хлорид дигидроксоалюминия.
— хлорид дигидроксоалюминия.
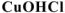 — хлорид гидроксомеди(П),
— хлорид гидроксомеди(П),
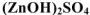 — сульфат гидроксоцинка,
— сульфат гидроксоцинка,
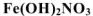 — нитрат дигидроксожслеза (III);
— нитрат дигидроксожслеза (III);
Кислоты и их соли
При растворении солей в воде образуются промежуточные соединения — гидраты. Иногда гидраты могут быть такими прочными, что при выделении растворенного вещества из раствора вода входит в состав растущего кристалла в химически связанном виде. Такие кристаллы называются кристаллогидратами: 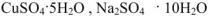 и др.
и др.
При прокаливании кристаллогидратов протекает реакция:
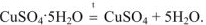
Свойства солей
Соли взаимодействуют:
с металлами, стоящими в ряду напряжений до металла, катион которого входит в состав соли
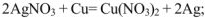
с основаниями
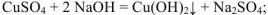
с кислотами
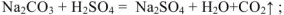
с солями
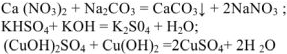
Рассмотрим пример названия основных классов неорганических соединений и составления их формул:
а) Назвать следующие химические соединения и определить степень окисления всех элементов соединений: 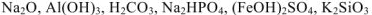
б) Написать формулы следующих химических соединений: оксид марганца (II), гидроксид стронция, нитрат хрома (III), дигидроортофосфат алюминия.
Ответ:
a) 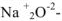 — оксид натрия
— оксид натрия
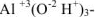 — гидроксид алюминия
— гидроксид алюминия
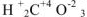 — угольная кислота
— угольная кислота
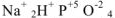 — гидроортофосфат натрия
— гидроортофосфат натрия
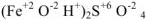 — сульфат гидроксожелеза (II)
— сульфат гидроксожелеза (II)
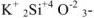 — метасиликат калия
— метасиликат калия
б) Формулы химических соединений:
оксид марганца (II) — 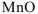
гидроксид стронция- 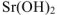
нитрат хрома (III)- 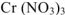
дигидроортофосфат алюминия — 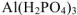
Между различными классами соединений существует генетическая связь. Из соединений одного класса можно получить соединения другого класса.
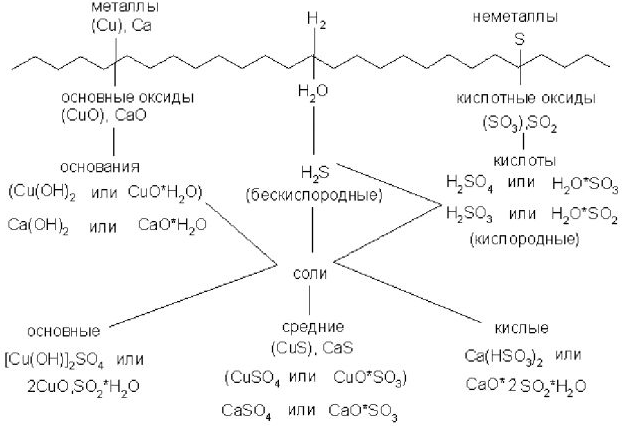
В верхней части схемы помещены две группы простых веществ — металлы и неметаллы, а также водород, строение атома которого отличается от строения атомов других элементов. На валентном слое атома водорода находится один электрон, как у щелочных металлов; в то же время, до заполнения электронного слоя оболочки ближайшего инертного газа — гелия — ему недостает также одного электрона, что роднит его с галогенами.
Волнистая черта отделяет простые вещества от сложных; она символизирует, что «пересечение» этой границы обязательно затрагивает валентные оболочки атомов в простых веществах, следовательно, любая реакция с участием простых веществ будет окислительно-восстановительной.
В левой части схемы под металлами помешены их типичные соединения — основные оксиды и основания, в правой части схемы помещены соединения, типичные для неметаллов, кислотные оксиды и кислоты. Водород, помещенный в верхней части схемы, дает очень специфический, идеально амфотерный оксид воду 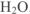 , которая в комбинации с основным оксидом дает основание, а с кислотным — кислоту. Водород в сочетании с неметаллами образует бескислородные кислоты. В нижней части схемы помещены соли, которые, с одной стороны, отвечают соединению металла с неметаллом, а с другой — комбинации основного оксида с кислотным.
, которая в комбинации с основным оксидом дает основание, а с кислотным — кислоту. Водород в сочетании с неметаллами образует бескислородные кислоты. В нижней части схемы помещены соли, которые, с одной стороны, отвечают соединению металла с неметаллом, а с другой — комбинации основного оксида с кислотным.
Приведенная схема до некоторой степени отражает и возможности протекания химических реакций — как правило, в химическое взаимодействие вступают соединения, принадлежащие разным половинам схемы.
НАПРИМЕР:
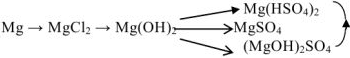
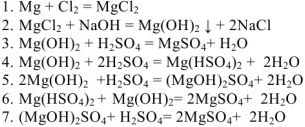
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:

