Оглавление:




Свойства воды и ее применение
- Свойства воды и ее применение Физические характеристики. Чистая вода-это бесцветная жидкость без вкуса, цвета и запаха, она кипит при 100°C, Замерзает при 0°C, ее максимальная плотность (4°C) принимается за единицу измерения. Лед менее плотный, чем жидкая вода, плавающая на поверхности.
- Вода обладает очень высокой теплоемкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому вода бассейна регулирует температуру Земли. Изучая, как образуется водород, мы знакомимся со свойствами воды. Активный металл (стр. 52) и некоторые неметаллы, например углерод (стр. 60) и вступает в замещение reaction.
Химическое свойство. Людмила Фирмаль
At высокие температуры, вода взаимодействует практически со всеми metals. In в этом случае водород замещается молекулами воды, образующими оксиды соответствующих металлов: Н. Н. Н. Zn + H20-Zn0 + H2f Под воздействием постоянного тока или высокой температуры (2000°C) вода разлагается на водород и кислород(стр. 14 и 50).
Вода вступает в реакцию со многими комплексными соединениями. Вещество. Это можно подтвердить, проведя следующие эксперименты: Эксперимент 1.Положите в фарфоровую чашку небольшой кусочек свежеиспеченного оксида кальция CaO (негашеная известь) и залейте водой (рис. 38). в этом случае выделяется большое количество тепла, за счет которого происходит химическая реакция place.
As в результате образуется рассыпчатый порошок, который при растворении в воде дает на ощупь похожий на мыло раствор. Уравнение взаимодействия оксида кальция с водой можно записать следующим образом: Рис.38.Взаимодействие оксида кальция с водой. САО + Н20 — * Са(0NU ^ Гидроксид кальция (основание) Оксид кальция Опыт 2.
Налейте небольшое количество воды в чашку и сожгите красный фосфор металлической ложкой. Оксид фосфора (V) P2O, который образуется в виде белого дыма, постепенно растворяется в воде и вступает в реакцию с водой. Это подтверждается в следующем experiment. In полученный раствор смешать с водой, добавить немного фиолетового цвета litmus.
At при этом цвет лакмуса в воде не меняется, и в полученном растворе лакмус становится красным. Вещество, под воздействием которого пурпурная лакмусовая бумажка становится красной, — это кислота. (Далее мы подробно рассмотрим их характеристики.) В этом случае образовалась металлическая кислота. Р205 + Н20 + 2NROe Фосфорная кислота При изучении дальнейших процессов химии мы подтверждаем, что вода может также вступать в реакцию с кислотами, основаниями, солями и многими органическими веществами.
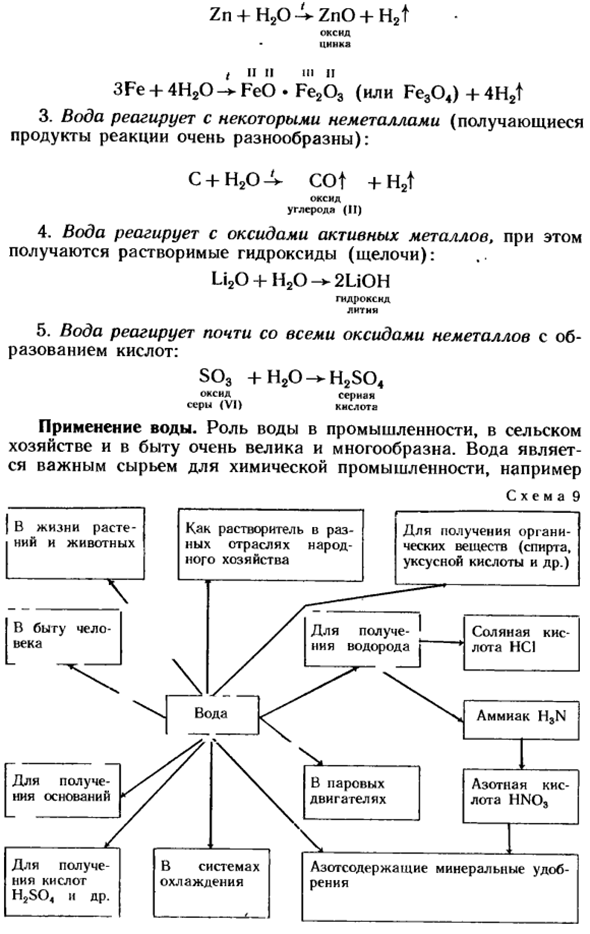
Примеры наиболее важных химических свойств воды: 1.Вода вступает в реакцию с активным металлом, образуя растворимые гидроксиды (щелочи) и водород. 2Li 4-2NOH 2LiOH + H2t Гидроксид лития 2.При нагревании вода вступает в реакцию с менее активными металлами, а продуктами реакции являются оксиды металлов и водород. Zn 4-H20 L-ZnO + H2t Оксид цинка t II II III II III 3Fe + 4H20 — > FeO * Fe203 (или Fe304)+ 4H2t 3.Вода реагирует с неметаллами(образующиеся продукты реакции очень разнообразны). с + Н2 — ^ П + H2t Окись Углерода*(второй)
- 4.Вода вступает в реакцию с оксидами активного металла, в результате чего образуется растворимый гидроксид (щелочь). Li20 + H20 2UOH Гидроксид лития 5.Вода реагирует почти со всеми неметаллическими оксидами с образованием кислот. ѕо3 + Н20 — * H2S04 Оксид серы Септическая (VI) кислота Полив. Роль воды в промышленности, сельском хозяйстве и повседневной жизни очень велика и разнообразна.
Вода является важным сырьем для химической промышленности. Например Схема 9 Для получения водорода (с. 50); способность воды реагировать с определенными оксидами используется для получения оснований и кислот. Вода является широко используемым растворителем. На рисунке 9 показана область водопользования.
Процесс бурного развития и урбанизации всех отраслей экономики 1 часто приводит к загрязнению водных объектов. Людмила Фирмаль
Советский Союз принял законы Об охране и рациональном использовании всех природных ресурсов, в том числе водных объектов. Государство выделяет большие суммы денег на строительство водоочистных сооружений. Например, Москва-река, протекающая через столицу, стала одной из 1 самых чистых в мире. Europe. It удалось сохранить Черноморский бассейн вблизи города Батуми, главного центра нефтяной промышленности, чистым и прозрачным.
Ответьте на вопрос 6-9. * I. используя анализ и синтез, мы опишем, как определить качественный и количественный состав воды и вывести ее химическую формулу. 2.In эвгенометр взорвал смесь, состоящую из 1 мл водорода и 6 мл кислорода. Какой газ и объем остался после взрыва? 3.Как очищается питьевая вода? 4.Как получить дистиллированную воду и где ее использовать 5.Какую природную воду, а не дистиллированную, можно использовать в системе охлаждения автомобиля?
6.Вода характеризуется реакциями разложения, соединения и замещения. * Создайте эти уравнения реакции и напишите название под уравнением вещества. 7.При взаимодействии воды с другими веществами могут образовываться: б)щелочи; в)щелочи и водород. Второй случай, который дает 2 примера каждого уравнения реакции. Под формулой вещества напишите его название. 8.Для каких целей используется вода в сельском хозяйстве и промышленности? Отвечая, воспользуйтесь своим производственным опытом. 9.Составьте резюме ответов, характеризующих воду, и следуйте плану, указанному на стр. 43(за исключением вопроса о получении).
Смотрите также:
| Вода. Состав воды | Растворы |
| Вода в природе и способы ее очистки | Растворимость веществ в воде |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.

