Оглавление:
Оксиды. Классификация. Свойства. Номенклатура
К наиболее важным и распространенным кислородсодержащим соединениям элементов относятся оксиды.
Оксиды — бинарные соединения элементов с кислородом в степени окисления -2. Общая формула оксидов 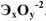 .
.
Почти все элементы образуют оксиды. Исходя из степени окисления кислорода и положения в ПС Д.И.Менделеева, состав оксидов можно представить простейшими формулами: 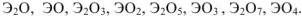 .
.
К оксидам не относятся соединения, содержащие атомы кислорода, связанные химической связью друг с другом ( 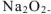 — пероксид натрия:
— пероксид натрия: 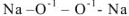 )
)
Название оксидов состоит соответственно из слова «оксид» плюс название элемента в родительном падеже единственного числа:
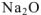 — оксид натрия,
— оксид натрия,
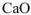 — оксид кальция
— оксид кальция
Если элемент проявляет переменную степень окисления, то в скобках дополнительно указывают степени окисления элемента:
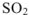 — оксид серы (IV),
— оксид серы (IV),
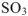 — оксид серы (VI).
— оксид серы (VI).
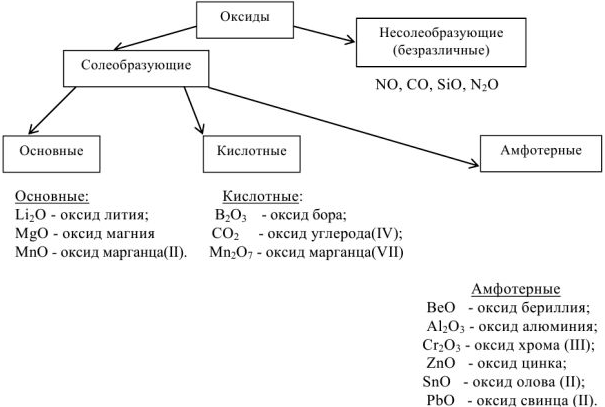
Несолеобразующими называют оксиды, которым не соответствуют ни кислоты, ни основания и поэтому, с точки зрения кислотно-основных свойств, их характер может быть назван безразличным.
Солеобразующими называются оксиды, которые образуют соли. Солеобразующие оксиды делятся на основные, амфотерные и кислотные. Основными называются оксиды, элемент которых при образовании соли или основания становится катионом. Для основных оксидов характерны ионные или сильно полярные связи между атомами, что обусловливает прочность их кристаллических решеток и способность к поляризации атомов кислорода.
К основным оксидам относятся:
- оксиды всех металлов главной подгруппы первой группы (щелочные металлы
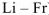 );
); - главной подгруппы второй группы (
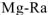 );
); - оксиды переходных металлов в низших степенях окисления ( например.
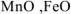 )
)
Кислотными называют оксиды, элемент которых при образовании соли или кислоты входит в состав аниона. Оксиды ( высшие) малоактивных металлов и неметаллических элементов характеризуются наличием ковалентных связей в молекуле. Они способны быть акцепторами поляризованных атомов кислорода. Большинство оксидов неметаллов являются кислотными оксидами 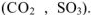 К неметаллам относятся элементы:
К неметаллам относятся элементы:
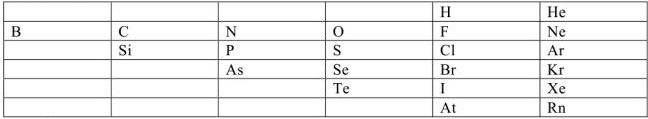
Остальные элементы — металлы.
Оксиды переходных металлов в высших степенях окисления проявляют преимущественно также свойства кислотных оксидов (например, 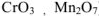 ) . Большинство кислот образуется при взаимодействии кислотных оксидов с водой. Поэтому кислотные оксиды называют ангидридами кислот.
) . Большинство кислот образуется при взаимодействии кислотных оксидов с водой. Поэтому кислотные оксиды называют ангидридами кислот.
Например : 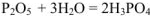
Элемент, образующий ангидрид, проявляет одинаковую степень окисления и в ангидриде, и в соответствующей ему кислоте:

Амфотерные оксиды в зависимости от условий реакции могут проявлять как кислотные, так и основные свойства. Например : 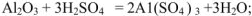
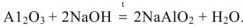
В нервом случае алюминий проявляет свойства металла и входит в состав электроположительной составляющей 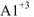 , во втором случае — свойства неметалла и входит в состав электроотрицательной составляющей формулы соли
, во втором случае — свойства неметалла и входит в состав электроотрицательной составляющей формулы соли 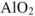 .
.
Соединения, обладающие амфотерными свойствами, образуют следующие металлы: 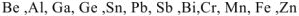 и др.
и др.
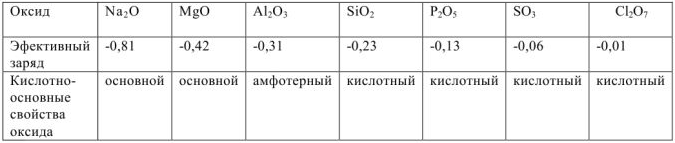
Кислотно-основной характер зависит от электроотрицательности, степени окисления элементов и эффективного заряда на атоме кислорода. Оксиды элементов с высокой электроотрицательностью имеют кислотный характер. Чем выше окислен металл, т.с. чем выше его степень окисления, тем более кислотным характером обладает оксид.
В периодах уменьшается отрицательный эффективный заряд на атомах кислорода и осуществляется постепенный переход от основных через амфотерные к кислотным оксидам.
Зависимость кислотно-основных свойств оксидов от эффективного заряда на атоме кислорода:
При увеличении степени окисления элемента усиливаются кислотные свойства оксида:
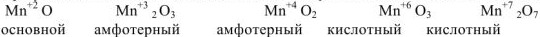
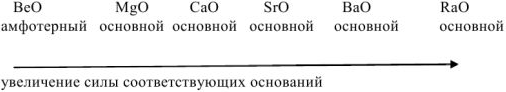
В главных подгруппах ПС при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов:
В результате взаимодействия элемента с кислородом образуются соединения с ионной или полярной ковалентной связью. Тип химической связи в оксидах зависит главным образом от химической природы атома, его заряда и размера. Типичные металлы образуют оксиды с ионной связью. С ослаблением металлических свойств элемента в соединениях наблюдается переход от ионной связи к ковалентной полярной с постепенным снижением степени полярности и больше проявляются кислотные свойства.
В пределах периодов с возрастанием порядкового номера элемента увеличивается заряд ядра атома и уменьшается его размер, что приводит к тому , что связь изменяется от ионной
к полярной ковалентной, а характер высших оксидов от основных через амфотерные к кислотным.
В пределах групп с возрастанием порядкового номера элемента степень окисления не изменяется , но вследствие увеличения энергетических уровней размер элемента возрастает. Это приводит к тому , что связь Э-О ослабевает, т.е становится более полярной ковалентной или ионной и в пределах групп усиливаются основные свойства оксидов.
Изменение химического характера оксидов одного элемента связано с тем, что с увеличением степени окисления элемента уменьшается его размер. Это приводит к тому, что тип химической связи изменяется от ионной к полярной ковалентной. Поэтому оксиды, в которых степень окисления наиболее низкая, относятся к основным, с высшей — к кислотным, а с промежуточной — к амфотерным.
Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О“’. поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Свойства оксидов
Основные:
1. Оксиды активных металлов взаимодействуют с водой с образованием щелочей:
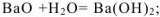
2. Взаимодействуют с кислотами, образуя соли:
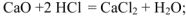
3. Взаимодействуют с кислотными оксидами, образуя соли:
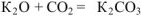
Кислотные:
1. Взаимодействуют с водой с образованием кислот:
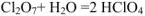
2. Взаимодействуют с основаниями с образованием кислых и средних солей:
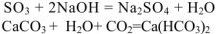
3. Взаимодействуют с основными оксидами .образуя соли:
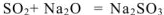
Амфотерные:
Оксид свинца и оксид алюминия, реагируя с сильной кислотой или кислотным оксидом, проявляет свойства основного оксида:
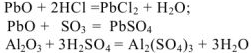
При взаимодействии с сильным основанием или основным оксидом — свойства кислотного оксида:
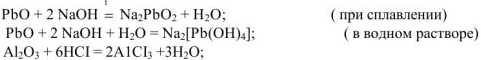
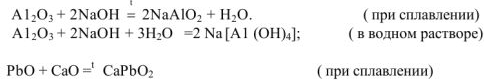
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:

