Оглавление:







Этилен. Гомологи этилена
- Чего следует опасаться при приеме этого лекарства? Гомологи этилена По международной номенклатуре многие углеводороды этилена называются алкенами. Структура молекул этилена. Электронная формула этилена выглядит следующим образом: Н. Н. Н. Н: С: С: Н• Экспериментально доказано, что в молекулах этилена и других углеводородов этого ряда 1 из двойных связей относительно легко разрывается, а 2-я-более durable.
- So например, когда этилен пропускают через бромистую воду, он становится обесцвеченным в результате добавления атомов брома. H2C = CH2 + Br2 — * BrH2C-CH2Bg 1,2-джибломо Этан Почему одна из 1 двойных связей между атомами углерода молекулы этилена не так сильна? Также напомним, что атом углерода имеет как S, так и p электроны в результате спаривания 2 $электронов на внешнем энергетическом уровне, и его облака могут вызвать гибридизацию(стр. 148).
На этот вопрос можно ответить на основе современных мыслей о соединениях o и i(I, с. 126). Людмила Фирмаль
В молекулах этилена гибридизации подвергаются 1 s электронное облако атомов углерода и 2 p электронное облако (sp2 гибридизация).таким образом, для каждого атома углерода существует 3 (всего- Рисунок 137.Образование связей st в молекуле. 138.Образование л-связей в молях этилена. Что я должен сказать своему врачу, прежде чем принимать это лекарство? 6) гибридизованное электронное облако (рис. 137) и 1 (только 2) негибридизованное Р-облако.
2. гибридные электронные облака атомов углерода перекрывают друг друга и образуют o-связь между атомами углерода. Гибридные электронные облака оставшихся 4 атомов углерода перекрываются в той же плоскости, что и 4 S электронные облака атомов водорода, образуя 4 а связи. Негибридизированные 2 р электронные облака атомов углерода перекрывают друг друга в плоскости, перпендикулярной плоскости связи А.
То есть образуется 1 Самосвязь(рис. 138). в результате в молекуле этилена между углеродом имеется 1 А-и 1 Самосвязь atoms. In углеродные соединения, I связи намного слабее, чем a связи. Под воздействием реагентов самосвязывание легко нарушается. Легко понять, что в молекулах насыщенных углеводородов атомы углерода могут свободно вращаться вокруг связи А.
Если существует не только связь, но и связь I между атомами углерода, то невозможно совершить такое вращение, не нарушив связь. Вопрос 1-3 (стр. 169). Гетеросексуальность и номенклатура. Углеводородная формула многих этиленов может быть получена из соответствующей насыщенной углеводородной формулы. Название ряда этиленовых углеводородов образуется путем изменения суффикса-или-термина соответствующего насыщенного углеводорода.
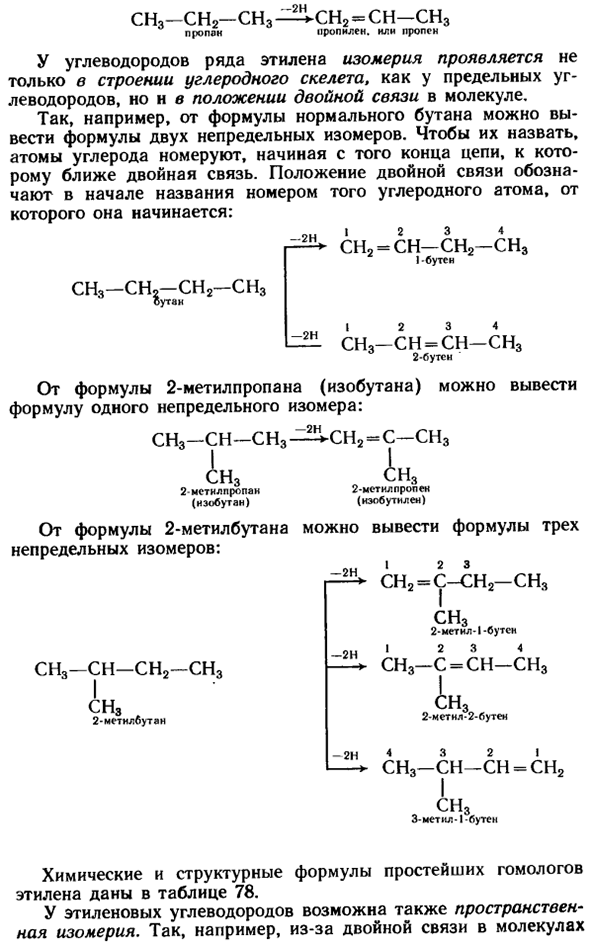
CI13-CH3 — * CH2 = CH2 Этан этилен, или Эттен — 2Н. CH2 = CH-CH3 Пропилен, или пропсн СН3-СН2-СН3 Пропан Во многих этиленовых углеводородах изомерия проявляется не только в структуре углеродного скелета, как в насыщенных углеводородах, но и в положении двойной связи в молекуле. Так, например, из Формулы нормальбутана можно вывести формулу 2 ненасыщенных isomers.
To назовите их, атомы углерода отсчитываются от конца цепи, где двойная связь ближе. Расположение двойной связи указывается номером атома углерода, с которого она начинается, в начале названия. 12, 3, 4. CH2 = CH-CH2-CHg 1 ботинок CH3-CHO-CH2-CH3 Бутан I 2 3 4 CH3-CH = CH-CHg 2 загрузки Формула 2-из метилпропана (изобутана) может быть получена Формула 1 ненасыщенного изомера. СН3-СН-СН3 — » — СН2-С-СН3 — 2Н. — 2Н.
2-Метилпропен (нзобутллен) 2-изопропилпропан(зобутан)) Формула 2-из метилбутана можно получить формулу 3 ненасыщенных изомеров: — 2ч 1 2 3 СН2 = С-СН2-СН3 СН3 2-метнл-1-буцн и 2 3 4 СН3-с = СН-sn3 — 2Н. CH3-CH-CH2-CH, CH3 2-мстилбутан 2-Месут Озил-2-Бутен 4 3 2 1 sn3-СН-СН = СН. СНЗ 3-Месть 1-butsn Химические формулы и структурные формулы простейших гомологов этилена приведены в таблице 78.
В этиленовых углеводородах пространственная изотропия также является possible. So например, для двойной связи в молекуле В — 2Н. Х11 2-Бутен Группа= C не может вращаться свободно hsn3 Его ось. Таким образом, метильные группы в пространстве могут располагаться в 2 различных положениях. Если заместитель изомерной молекулы находится на одной стороне двойной связи, он называется ЦИС-изомером, а если он находится на противоположной стороне, он называется Транс-изомером 1(Таблица 78). Таблица 78.
- Простейшие гомологи этилена Молекулярная формула (структурное название формулы) QH4 QHfi CH2-CHj CH3-CH = CH2 этилен (этен)пропилен) QHg QH8 CH3-CH2-CH = CHj OW r / CH3 H ^ H 1-Бутен 2-Бутен (^ ys-форма) QH8 QHe sn3hr g ^ n H-С=, СчСН3CH3-с = CHJ 1 CH3 2-Бутен (Транс-тело )2-метилпропен В отличие от известного нам типа изомерии (изомерия углеродного скелета и положение двойной связи), в этом случае расположение атомов или групп атомов в пространстве различно.
Этот тип гетеросексуальности называется пространственной или stereosexual. It возможно с ненасыщенными углеводородами, которые содержат группы различных атомов или атомов. Поэтому в этилене нет места противоположному полу. Вопрос 4-6 (стр. 169). Мы получили ваши отзывы.
1) этилен в лабораторных условиях получают нагреванием смеси концентрированной серной кислоты с этиловым спиртом. Людмила Фирмаль
С2Н5ОН—Н2С =СН2+НОН Ч, так » этиленеума 2) многие этиленовые углеводороды также получают дегидрированием насыщенных углеводородов. 2CH4catalnzato1> С2Н4 + 2Н2 / sn3-sn3 — — — а: Н2 = СН2 + Н5 — Атап ^катализатора * ГНМ * Из широт СНГ-по эту сторону, транс-по другую сторону. 3)в производстве этилен получают из природного газа и в процессе разложения нефти(стр. 191 и 194).
4) дигалогенирование взаимодействие насыщенных углеводородов с металлами позволяет получать большое количество этиленовых углеводородов. CH2Bg-CHBg-CH3 + Zn-H2C-CH3 + ZnBr2 1,2-дибломопропил пропилен Если атом галогена не находится в соседних атомах углерода, то может образоваться циклопропан(стр. 156). 5.Под действием спиртового раствора щелочи на Галогенированное производное отделяется галогенид водорода и образуется углеводород с двойной связью.
Н Я п Ч С [С1__к__ | СН2 Я + я * ’второй + примесями КС1 + НОО Ч — с — [hIZZSQ ffSEp ЗП J i — И-с-ч СН3 Я Х 7-пропиленгликоль Ответьте на вопрос 7 (стр. 169).Решите задачу I (стр. 169). Физические характеристики. Этилен-бесцветный газ, почти без запаха, немного легче воздуха и менее растворим в воде. Пропилен и бутен (бутилен) также являются газообразными в нормальных условиях. Пентен SBN из 0-октадеценовых углеводородов C ^ Nde в жидком состоянии, начиная с неадезена C19H38-находится в твердом состоянии. Химическое свойство.
Химические свойства этилена и его гомологов в значительной степени определяются наличием двойных связей в молекуле. Они характеризуются реакцией присоединения, окисления и полимеризации. 1.Дополнительные реакции. 1) этилен и его гомологи взаимодействуют с halogens.
So например, они обесцвечивают бромистую воду: Н2С=СН2+Вг2СН2Вг—СН2Вг 1,2-джибломо Этан 2) аналогично происходит добавление водорода (гидрирование этилена и его гомологов): Н2С=СН2-fH2 катализатора>Н3С—СН3 этилен» Тан 3) в присутствии серной или фосфорной кислоты и других катализаторов этилен связывает воду(реакция гидратации): Т Н2с = СН2 + HOH_ato ^ СН3-СН2-он Этиловый спирт
Эта реакция используется для производства этилового спирта в промышленности. 4) этилен и его гомологи также объединяют галоген-водород: H2C = CH2 + HBg — к CH3-CH2Bg «Тшбрнчнл Н2С=СН2+ HCI С-СН3—СН2С1 Т И.»| . 7/11: 1 Этилхлорид применяют для местного обезболивания лекарственных средств. В. В. По правилам Марковникова углеводороды пропилена и ряда последующих этиленов вступают в реакцию с Галогенидом водорода.
Водород связывается чаще всего, а атомы галогена связываются с наименее гидрированными атомами углерода. CH2 = CH-CH3 + HBg — * * CH3-CHBg — — CH3 Пролин 2-Бромпропан Изучая реакции замещения с участием насыщенных углеводородов, я убедился, что они протекают по механизму свободных радикалов(с. 153).Теперь рассмотрим механизмы, с помощью которых протекают аддитивные реакции, характерные для ненасыщенных углеводородов occur.
As в качестве примера рассмотрим взаимодействие этилена с пропиленом и бромистым водородом. Как вы знаете, ковалентная связь молекулы бромистого водорода полярна. Атом водорода в нем имеет частично положительный заряд, а атом брома частично отрицательный charge. In в результате взаимодействия электроны L-связи ненасыщенного углеводорода притягивают положительно заряженный атом водорода и отталкивают отрицательно заряженный атом брома.
Вся электронная пара полностью перемещается к атому брома. В результате образуются положительно заряженные ионы водорода H и отрицательно заряженные ионы брома Br. In в этом случае расщепление ковалентных связей в молекуле бромистого водорода осуществляется по ионному механизму. Изменения происходят в молекулах этилена.
При взаимодействии с электронами l-связи этого углеводорода ион водорода H1 связывается с 1 атомом углерода. В результате сдвига электронов L-связи 1 атом углерода приобретает положительный заряд. И также можно использовать следующие методы:: Н ни Ионы брома связываются с атомами углерода, которые приобрели положительный заряд. н с: н+: БВ:•••• н Br. Н.•••• * C * C••••• И Н + с:•• н Н н н В результате добавление галогенидов водорода к ненасыщенным соединениям происходит по ионному механизму.
С точки зрения ионного механизма В. В. суть закона Марковникова объясняется следующим образом: в результате сдвига электронной плотности молекулы пропилена 2-й атом углерода, присоединенный к метильному радикалу, оказывается более положительно заряженным, чем 1-й: (?+ Я C = C Cr-H, 1, 2 Нин Величина электроотрицательности атома углерода больше, чем величина атома водорода(I, с. 123).
Таким образом, атом углерода метильной группы приобретает относительно большой отрицательный заряд, чем другие атомы углерода, в результате сдвига электронной плотности от 3 атомов водорода. Этот избыточный отрицательный заряд смещает движущиеся самостоятельное электронное облако со 2-го атома углерода к первому углеродному атому(см. Рисунок).
В результате такого сдвига, первый атом углерода (С1) приобретает больший отрицательный заряд (6〜), а 2-ой атом углерода (С2) становится более положительным (N*) по сравнению с ним. В результате, атом водорода (более положительный) связывается с атомом углерода (больше негативного), в то время как галоген (более отрицательным) связывается с атомом углерода (более положительный).
Многие химические реакции с участием органического вещества вызываются либо свободными радикалами, либо ионными механизмами во всех этих реакциях, некоторые связи разрываются и образуются новые связи. Раскрой соединения в общих чертах можно представить следующим образом: Ай-Дж Б А — + Б (свободно-радикальному механизму) А: Б〜 * А + + Б — (механизм Иона) 2.Реакция окисления.
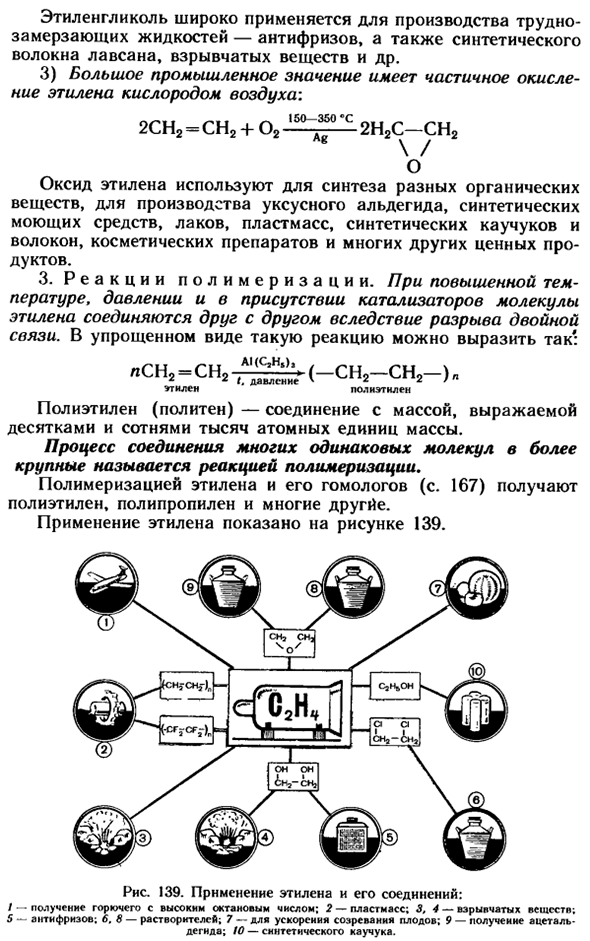
1) этилен и его гомологи горят в воздухе: С2Н4 4-302 2 винтика+ 2H20 Этилен и его газообразные гомологи образуют взрывчатую смесь с воздухом. 2) этилен и его гомологи легко окисляются кислородом перманганата калия, например example. In в этом случае последний раствор будет обесцвечен: CH2 = CH2 + o + H2O ^^ HO-CH2-CH2-OH * Этиленгликоль Этиленгликоль широко используется в производстве антифриза, синтетических волокон Lab-San, взрывчатых и других замораживающих жидкостей.
3) парциальное окисление этилена кислородом воздуха имеет большое промышленное значение. 2CH2 =СН2 + 02 15 ° −350’С2Н2С −2С-СН2 \ / О Этиленоксид используется для синтеза различных органических веществ, уксусного альдегида, синтетических моющих средств, лаков, пластмасс, синтетических каучуков и волокон, косметики и многих других ценных продуктов. 3.Полимеризация reaction.
At при высоких температурах, давлениях и в присутствии катализаторов молекулы этилена связываются друг с другом расщеплением двойника bonds. In в упрощенном виде такая реакция может быть выражена следующим образом Ичо = чч — (- Чо— Чо—) л * * /.Давление x * » 7 Этилен, полиэтилен Полиэтилен (полиэтилен) — это соединение с массой, выраженной в массе от нескольких десятков тысяч до нескольких сотен тысяч единиц.
Процесс объединения многих одинаковых молекул в более крупные молекулы называется реакцией полимеризации. Полимеризация этилена и его гомологов (с. 167)приводит к получению полиэтилена, полипропилена и многих других. Применение этилена показано на рисунке 139. 139.Применение этилена и его соединений: / * * Получение высокооктанового топлива.
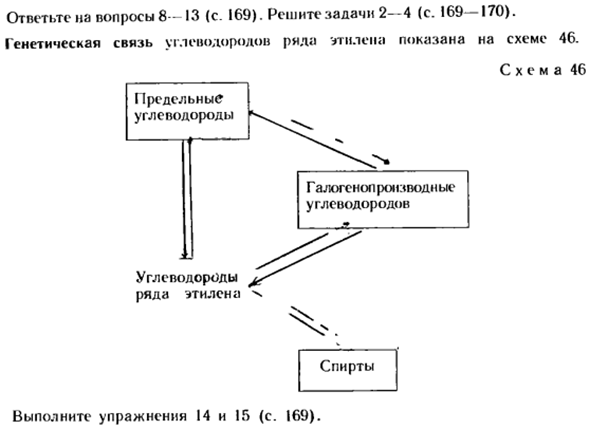
2-пластик; 3, 4-взрывчатые вещества; 5-антифриз; 6. 8-растворитель; 7-ускоряют созревание плодов; 9-получают дегидратацию ацеталя; 10-синтетический каучук. Вопрос 8-13 (стр. 169).Выпуск 2-4 (стр. 169-170).Генетическое родство многих этиленовых углеводородов показано на схеме 46. Образец 46 Этилен Выполните упражнения 14 и 15(стр. 169). Алкоголь
Смотрите также:
| Распространенность элементов в земной коре. Простые вещества | Понятие о высокомолекулярных соединениях |
| Непредельные углеводороды | Диеновые углеводороды (алкадиены) |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.

