Ионно-молекулярные уравнения
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, осадками и газами участвуют, находящиеся в растворе ионы. Поэтому механизм протекания реакций в растворе наиболее полно выражается при замене молекулярных уравнений ионно-молекулярными. В таких уравнениях слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а сильные электролиты в виде ионов.
Например:
1. 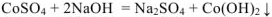 — молекулярное уравнение
— молекулярное уравнение
Ею можно изобразить в ионной форме (иногда такую форму записи называют ионномолекулярной. Еси формулы растворимых сильных электролитов записать в виде тех ионов, на которые они диссоциируют в растворе, а формулы слабых электролитов в виде молекул, то уравнение реакции можно представить в виде:
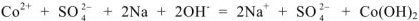
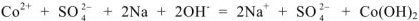 — полное ионно-молекулярное уравнение
— полное ионно-молекулярное уравнение
Исключая из данного уравнения одинаковые ионы в правой и левой частях, получим запись уравнения в сокращенной ионно-молекулярной форме:
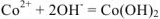 — сокращенное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
Такое уравнение показывает, что реакция между сульфатом кобальта (II) и гидроксидом натрия сводится к взаимодействию между ионами кобальта (II) и гидроксид ионами с образованием гидроксида кобальта (II). С точки зрения теории электролитической диссоциации ионы 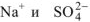 принимают участия в реакции. По такому же принципу составим уравнения других реакций обмена в водных растворах электролитов (примеры 2 -6).
принимают участия в реакции. По такому же принципу составим уравнения других реакций обмена в водных растворах электролитов (примеры 2 -6).
2. 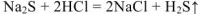 — молекулярное уравнение
— молекулярное уравнение
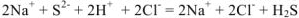 — полное ионно-молекулярное уравнение
— полное ионно-молекулярное уравнение
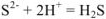 — сокращенное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
3. 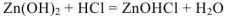 — молекулярное уравнение
— молекулярное уравнение
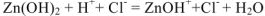 полное ионно-молекулярное уравнение
полное ионно-молекулярное уравнение
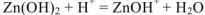 — сокращенное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
4. 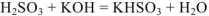 — молекулярное уравнение
— молекулярное уравнение
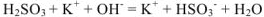 — полное ионно-молекулярное уравнение
— полное ионно-молекулярное уравнение
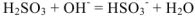 — сокращенное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
5. 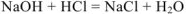 — молекулярное уравнение
— молекулярное уравнение
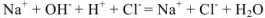 — полное ионно-молекулярное уравнение
— полное ионно-молекулярное уравнение
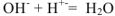 — сокращенное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
Рассмотренные примеры показывают, что обменные реакции в растворах электролитов протекают в направлении связывания ионов, приводящего к образованию осадков, газов или слабых электролитов.
С другой стороны на основании сокращенного ионно-молекулярного уравнения можно составить уравнение реакции в полном молекулярном виде. Например:
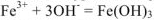 — сокращенное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
Согласно теории электролитической диссоциации катионы металлов образуются при диссоциации солей, которые являются сильными электролитами. В данном случае необходимо выбрать хорошо растворимую соль. Так как все соли азотной кислоты являются растворимым, то можно использовать 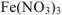 . В качестве второго реагента используем раствор щелочи
. В качестве второго реагента используем раствор щелочи 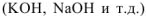 . так как основания металлов 1 и II главных подгрупп таблицы Менделеева являются сильными электролитами. Тогда
. так как основания металлов 1 и II главных подгрупп таблицы Менделеева являются сильными электролитами. Тогда
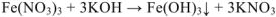
Рассмотрим пример взаимодействия в растворе хлорида калия и сульфата натрия:
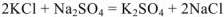
Запишем уравнение реакции в ионной форме:
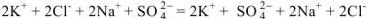
В левой и правой частях уравнения записаны одни и те же ионы. В соответствии с теорией электролитической диссоциации такие реакции не протекают. Действительно, при сливании растворов 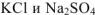 видимых изменений не происходит. Однако, если упарить раствор досуха, то в остатке обнаружатся все четыре соли:
видимых изменений не происходит. Однако, если упарить раствор досуха, то в остатке обнаружатся все четыре соли: 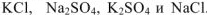 . Такую реакцию обмена следует отнести к обратимым.
. Такую реакцию обмена следует отнести к обратимым.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Факторы, влияющие на направленность химических процессов |
| Методы расчета изменения энергии Гиббса |
| Физические свойства в химии |
| Химические свойства воды в химии |

