Кислоты и основания. Классификация. Свойства. Номенклатура
В периодах ПС слева направо уменьшаются основные и возрастают кислотные свойства.
Например:

В периоде происходит изменение характера ионизации гидроксидов:
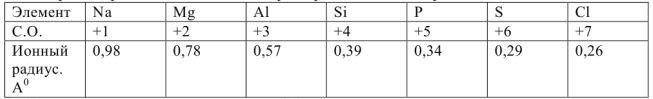
В ряду степень окисления растет , эффективные ионные радиусы заметно уменьшаются и возрастает объемная плотность заряда. Поэтому поляризующее действие ионов элементов, приводящее к перераспределению электронной плотности между связями Э-0 и Э-Н. возрастает в том же направлении.
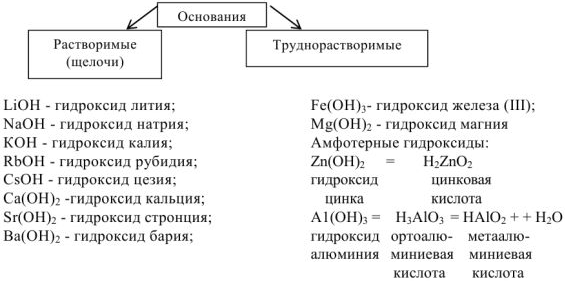
В группах нарастает сила оснований:

Основания — химические соединения, которые в растворе диссоциируют с образованием гидроксид ионов 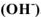 . Общая формула оснований
. Общая формула оснований 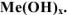
Основания в воде диссоциируют на ионы металла (аммония — в случае 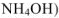 и гидроксидионы. Никаких других анионов, кроме гидроксид-ионов, основания нс образуют.
и гидроксидионы. Никаких других анионов, кроме гидроксид-ионов, основания нс образуют.
Название оснований состоит из слова «гидроксид» плюс название металла в родительном падеже. Если металл проявляет переменную степень окисления, то в скобках после названия металла указывается степень его окисления. Число гидроксид ионов определяет кислотность основания:
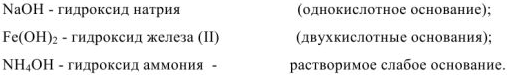
Растворы щелочей мыльные на ощупь. Изменяют окраску индикаторов: красного лакмуса — в синий цвет, бесцветного фенолфталеина — в малиновый цвет.
Свойства оснований:
Основания реагируют
с кислотами ( реакция нейтрализации)
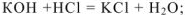
с кислотными оксидами
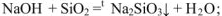
с солями
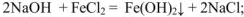
Амфотерными называются гидроксиды, которые при диссоциации образуют одновременно и катионы 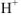 и гидроксид-ионы
и гидроксид-ионы 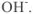 . Такими являются
. Такими являются 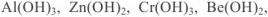
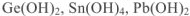 и др.
и др.
Амфотерные гидроксиды реагируют с кислотами и основаниями
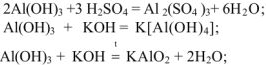
Кислоты — химические соединения, содержащие атомы водорода, способные замещаться атомами металлов. С позиций теории электролитической диссоциации к кислотам относятся вещества, способные диссоциировать в растворе с образованием ионов водорода (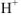 ).
).
Основность кислот — число ионов водорода, которые отщепляются от молекулы кислоты при ее диссоциации или обмениваются на катионы металла при взаимодействии кислоты с основанием или с металлом. По основности кислоты делятся на одноосновные 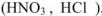 , двухосновные
, двухосновные 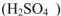 , трехосновные
, трехосновные 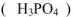 и т.д.
и т.д.
Общая формула бескислородных кислот — 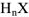 , где X- галоген, неорганический радикал типа CN и др. Общая формула кислородсодержащих кислот
, где X- галоген, неорганический радикал типа CN и др. Общая формула кислородсодержащих кислот 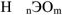 , где Э — кислотообразующий элемент.
, где Э — кислотообразующий элемент.
Кислоты в воде диссоциируют на ионы водорода и кислотные остатки — анионы. Никаких других катионов, кроме ионов водорода, кислоты не образуют. Числом ионов водорода, образуемых каждой молекулой кислоты при диссоциации, определяется заряд кислотного остатка (аниона). Хлороводородная и азотная кислоты образуют только однозарядные кислотные остатки 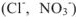 ; молекула серной кислоты
; молекула серной кислоты 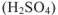 может образовать два кислотных остатка: однозарядный
может образовать два кислотных остатка: однозарядный 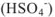 и двухзарядный
и двухзарядный 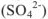 ; молекула фосфорной кислоты может дать три кислотных остатка: однозарядный, двухзарядный и трехзарядный
; молекула фосфорной кислоты может дать три кислотных остатка: однозарядный, двухзарядный и трехзарядный 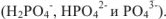 .
.
Название бескислородных кислот составляют, добавляя к корню русского названия кислотобразующего элемента (или к названию группы атомов, например CN — циан), суффикс -о- и окончание -водород-: 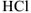 — хлороводород,
— хлороводород, 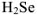 — селеноводород,
— селеноводород, 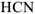 -циановодород.
-циановодород.
Названия кислородсодержащих кислот также образуются от русского названия соответствующего элемента с добавлением слова «кислота». При этом название кислоты, в которой элемент находится вы высшей степени окисленности, оканчивается на -ная- или -овая-; например, 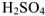 — серная кислота,
— серная кислота, 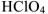 — хлорная кислота,
— хлорная кислота, 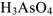 — мышьяковая кислота. С понижением степени окисленности кислотообразующего элемента окончания изменяются в следующей последовательности: -оватая- (
— мышьяковая кислота. С понижением степени окисленности кислотообразующего элемента окончания изменяются в следующей последовательности: -оватая- (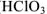 — хлорноватая кислота), -истая- (
— хлорноватая кислота), -истая- (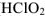 — хлористая кислота), -оватистая- (
— хлористая кислота), -оватистая- (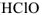 — хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисленности, то название кислоты, отвечающее низшей степени окисленности элемента, получает окончание истая- (
— хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисленности, то название кислоты, отвечающее низшей степени окисленности элемента, получает окончание истая- (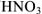 — азотная кислота,
— азотная кислота, 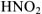 — азотистая кислота).
— азотистая кислота).
Одному и тому же кислотному оксиду (например, 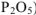 ) могут соответствовать несколько кислот, содержащих по одному атому данного элемента в молекуле (например,
) могут соответствовать несколько кислот, содержащих по одному атому данного элемента в молекуле (например, 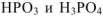 ). В подобных случаях к названию кислоты, содержащей наименьшее число атомов кислорода, добавляется приставка -мета-, а к названию кислоты, содержащей наибольшее число атомов кислорода — приставка -орто- (
). В подобных случаях к названию кислоты, содержащей наименьшее число атомов кислорода, добавляется приставка -мета-, а к названию кислоты, содержащей наибольшее число атомов кислорода — приставка -орто- (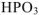 — метафосфорная кислота,
— метафосфорная кислота, 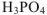 — ортофосфорная кислота). Если же молекула кислоты содержит несколько атомов кислотообразующего элемента, го название кислоты снабжается соответствующей русской числительной приставкой,
— ортофосфорная кислота). Если же молекула кислоты содержит несколько атомов кислотообразующего элемента, го название кислоты снабжается соответствующей русской числительной приставкой, 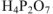 — двуфосфорная кислота,
— двуфосфорная кислота, 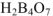 — четырехборная кислота.
— четырехборная кислота.
Некоторые кислоты содержат в своем составе группировку атомов  . Такие кислоты рассматриваются как производные пероксида водорода и называются пероксокислотами (старое название — надкислоты). Названия подобных кислот снабжаются приставкой -пероксо- и, если необходимо, русской числительной приставкой, указывающей число атомов кислотообразующего элемента в молекуле кислоты; например,
. Такие кислоты рассматриваются как производные пероксида водорода и называются пероксокислотами (старое название — надкислоты). Названия подобных кислот снабжаются приставкой -пероксо- и, если необходимо, русской числительной приставкой, указывающей число атомов кислотообразующего элемента в молекуле кислоты; например, 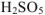 -пероксосерная кислота, H2S2OK — пероксодвусерная кислота.
-пероксосерная кислота, H2S2OK — пероксодвусерная кислота.
Свойства кислот:
Кислоты реагируют:
с основаниями ( реакция нейтрализации)
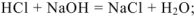
с основными оксидами
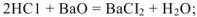
с металлами, стоящими в электрохимическом ряду напряжений до водорода, вытесняя водород из кислот
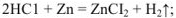
с солями с образованием слабого электролита, нерастворимого соединения или газообразного вещества
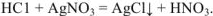
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:

