Зависимость величины электродного потенциала от концентрации ионов и температуры. Уравнение Нернста
В общем виде зависимость величины электродного потенциала от концентрации ионов и температуры выражается уравнением Нернста.
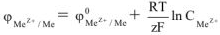
где 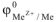 — электродный потенциал металла в растворе, содержащем катионы
— электродный потенциал металла в растворе, содержащем катионы 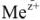 , в
, в
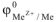 — стандартный электродный потенциал, в (табл. 1).
— стандартный электродный потенциал, в (табл. 1).
R — универсальная газовая постоянная, 8,314 Дж/мольК
Т — абсолютная температура, К
F — число Фарадея, 96500 кл/моль
z — число электронов в данной полуреакции.
Для температуры 298К.
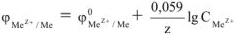
Если концентрация соли в растворе не превышает 0,001 моль/л, то уравнение Нернста можно подставлять значение концентрации, выраженной в молях на литр. При более высоких концентрациях соли, хотя растворы солей и относятся к сильным электролитам (диссоциируют в воде нацело), кажущаяся степень диссоциации, благодаря силам притяжения между противоположно заряженными ионами, в растворе меньше единицы. В связи с этим расчет ионной концентрации проводят по формуле:
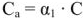
где 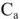 — активная, или эффективная концентрация ионов в растворе с учетом сил взаимодействия между ионами, моль/л;
— активная, или эффективная концентрация ионов в растворе с учетом сил взаимодействия между ионами, моль/л;
С — аналитическая концентрация вещества, моль/л;
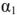 — кажущаяся степень диссоциации.
— кажущаяся степень диссоциации.
Приближенные значения кажущейся степени диссоциации солей в зависимости от их концентрации приведены в таблице 2.
Таблица 2
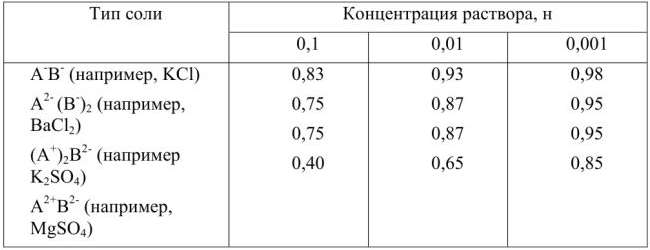
Соли (приближенные значения, 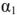 при 18°С)
при 18°С)
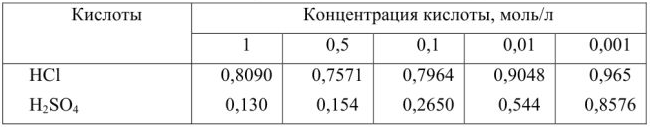
Кислоты (приближенные значения 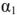 при 25)
при 25)
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Осмос в химии |
| Гальванический элемент в химии |
| Классификация коррозионных процессов в химии |
| Скорость коррозии и ее характеристика в химии |

