Оглавление:

| Здравствуйте! Я Людмила Анатольевна Фирмаль, занимаюсь помощью студентам более 17 лет. У меня своя команда грамотных, сильных преподавателей. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И неважно – она по объёму на две формулы или огромная, сложно структурированная, на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте. |
| Если что-то непонятно — вы всегда можете написать мне в WhatsApp и я вам помогу! |
Как заказать выполнение заданий по химии
Вы можете написать сообщение в WhatsApp. После этого я оценю ваш заказ и укажу стоимость и срок выполнения вашей работы. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за вашу работу, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл готовой работы в личные сообщения.
Сколько может стоить заказ химии
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости, загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ
Сначала пришлите задание, я оценю, после вышлю вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Гарантии и исправление ошибок
В течение 1 года с момента получения Вами готового решения заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Чуть ниже я предоставила примеры оформления заказов по некоторым темам химии, так я буду оформлять ваши работы если закажите у меня, это не все темы, это лишь маленькая часть их, чтобы вы понимали насколько подробно я оформляю.
Основные понятия и законы химии моль. Молярная масса
Молярная масса — это отношение массы вещества к количеству вещества., т. е.
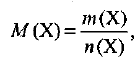
где 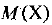 — молярная масса вещества
— молярная масса вещества 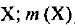 — масса вещества
— масса вещества 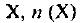 — количество вещества X. Единица СИ молярной массы — кг/моль, однако обычно используется единица г/моль. Единица массы — г, кг. Единица СИ количества вещества — моль.
— количество вещества X. Единица СИ молярной массы — кг/моль, однако обычно используется единица г/моль. Единица массы — г, кг. Единица СИ количества вещества — моль.
Пример оформления заказа №1
Какое количество вещества алюминия содержится в образце этого металла массой 10,8 г?
Решение:
Молярная масса алюминия составляет:
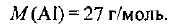
По уравнению (1.1) определяем количество вещества алюминия в образце:
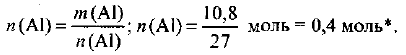
Пример оформления заказа №2
Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
Решение:
Молярная масса оксида серы (VI) составляет:
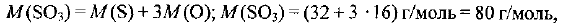
где  — молярные массы атомных серы и кислорода. Определяем количество вещества оксида серы (VI):
— молярные массы атомных серы и кислорода. Определяем количество вещества оксида серы (VI):
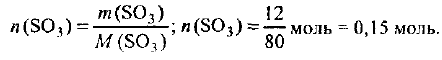
Пример оформления заказа №3
Определите массу карбоната натрия количеством вещества 0,25 моль.
Решение:
Молярная масса карбоната натрия составляет:
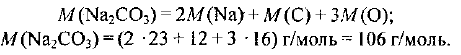
Определяем массу 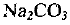 :
:
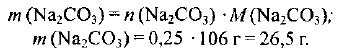
Расчеты по химическим формулам. Массовая доля
Массовая доля вещества — отношение массы данного вещества в системе к массе всей системы, т. е.
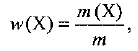
где 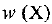 — массовая доля вещества
— массовая доля вещества 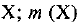 — масса вещества
— масса вещества 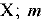 — масса всей системы. Массовая доля — безразмерная величина. Ее выражают в долях от единицы или в процентах. Например, массовая доля атомного кислорода составляет 0,42, или 42%, т. е.
— масса всей системы. Массовая доля — безразмерная величина. Ее выражают в долях от единицы или в процентах. Например, массовая доля атомного кислорода составляет 0,42, или 42%, т. е. 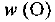 = 0,42*. Массовая доля атомного хлора в хлориде натрия составляет 0,607, или 60,7%, т. е.
= 0,42*. Массовая доля атомного хлора в хлориде натрия составляет 0,607, или 60,7%, т. е. 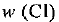 = 0,607.
= 0,607.
Пример оформления заказа №4
Вычислите массовую долю углерода в карбиде кальция 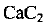 .
.
Решение:
Молярные массы веществ равны: М (С) = 12 г/моль, 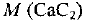 = 64 г/моль. Выбираем для расчетов образец карбида кальция количеством вещества 1 моль, т. е.
= 64 г/моль. Выбираем для расчетов образец карбида кальция количеством вещества 1 моль, т. е. 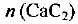 = 1 моль. Тогда масса карбида равна
= 1 моль. Тогда масса карбида равна
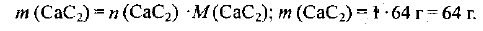
Из формулы карбида кальция 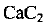 следует, что количество вещества атомного углерода в два раза больше количества вещества
следует, что количество вещества атомного углерода в два раза больше количества вещества 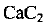 , т. е.
, т. е.
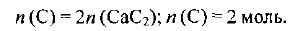
Определяем массу углерода:
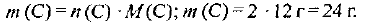
Находим массовую долю углерода в карбиде:
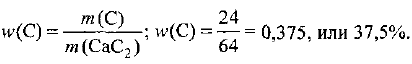
Пример оформления заказа №5
В состав минерального удобрения аммофоса входят дигидрофосфат аммония 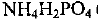 (массовая доля 85%), гидрофосфат аммония
(массовая доля 85%), гидрофосфат аммония 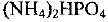 (8%) и примеси, которые не содержат азот. Определите массовую долю азота в аммофосе и количество вещества атомного азота в удобрении массой 200 кг.
(8%) и примеси, которые не содержат азот. Определите массовую долю азота в аммофосе и количество вещества атомного азота в удобрении массой 200 кг.
Решение:
Определяем массы и количества веществ дигидрофосфата аммония и гидрофосфата аммония в аммофосе:
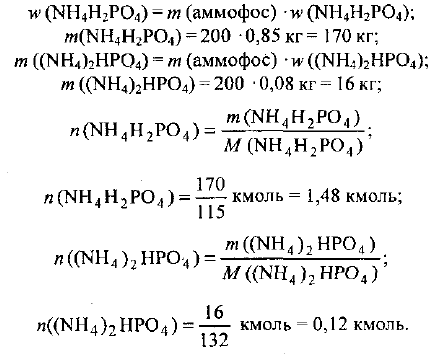
Из формулы дигидрофосфата аммония следует:
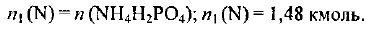
Из формулы гидрофосфата аммония следует:
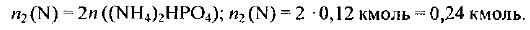
Общее количество вещества атомного азота в аммофосе массой 200 кг составляет:
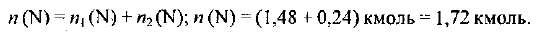
Находим массу азота:
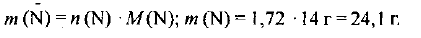
Определяем массовую долю азота в аммофосе:
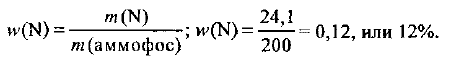
Вывод формул соединений
Пример оформления заказа №6
Массовые доли серы и кислорода в оксиде серы равны соответственно 40 и 60%. Определите простейшую формулу это-it) оксида.
Решение:
Для расчетов выбираем массу оксида, равную 100 г, т. е. m (оксида) = 100 г. Тогда массы серы и кислорода будут равны:
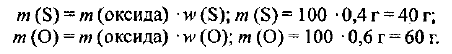
Количества веществ атомных серы и кислорода составят:
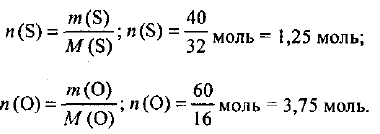
Находим отношение количеств веществ серы и кислорода:

Разделив правую часть равенства на меньшее число (1,25), получаем
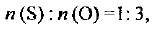
т. е. простейшая формула соединения SO3.
Молярный объем газов. Законы идеальных газов. Объемная доля
Молярный объем газа равен отношению объема газа к количеству вещества этого газа, т. е.
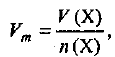
где  — молярный объем газа — постоянная величина для любого газа при данных условиях; V(X) — объем газа
— молярный объем газа — постоянная величина для любого газа при данных условиях; V(X) — объем газа 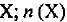 — количество вещества газа X. Молярный объем газов при нормальных условиях (нормальном давлении
— количество вещества газа X. Молярный объем газов при нормальных условиях (нормальном давлении 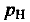 = 101 325 Па ~ 101,3 кПа и температуре
= 101 325 Па ~ 101,3 кПа и температуре 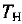 = 273,15 К — 273 К) составляет
= 273,15 К — 273 К) составляет 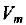 = 22,4 л/моль*.
= 22,4 л/моль*.
В расчетах, связанных с газами, часто приходится переходить от данных условий к нормальным или наоборот. При этом удобно пользоваться формулой, следующей из объединенного газового закона Бойля — Мариотта и Гей-Люссака:
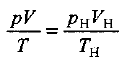
где р—давление; V — объем: Т — температура; индекс «н» указывает на нормальные условия.
Состав газовых смесей часто выражают при помощи объемной доли — отношения объема данного компонента к общему объему системы, т. е.
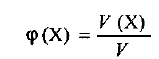
где 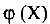 — объемная доля компонента X; И (X) — объем компонента X; V — объем системы. Объемная доля ~ безразмерная величина, ее выражают в долях от единицы или в процентах.
— объемная доля компонента X; И (X) — объем компонента X; V — объем системы. Объемная доля ~ безразмерная величина, ее выражают в долях от единицы или в процентах.
Пример оформления заказа №7
Какую массу будет иметь азот объемом 30 л при нормальных условиях?
Решение:
Молярный объем газа при нормальных условиях 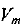 = 22,4 л/моль. В соответствии с формулой (1.3) рассчитываем количество вещества молекулярного азота:
= 22,4 л/моль. В соответствии с формулой (1.3) рассчитываем количество вещества молекулярного азота:
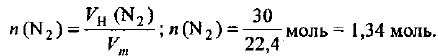
Определяем .массу азота:
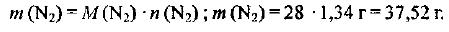
Пример оформления заказа №8
Какой объем займет при нормальных условиях хлороводород массой 14,6 г?
Решение:
Определяем количество вещества хлороводорода:
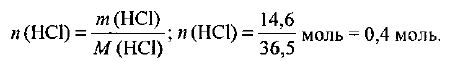
В соответствии с формулой (1.3) объем хлороводорода при нормальных условиях составляет:
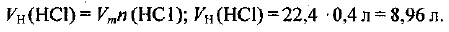
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. Однако в реальных химических процессах из-за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с законом сохранения массы веществ. Выход продукта реакции (или массовая доля выхода)—это выраженное в процентах отношение массы реально полученного продукта к его массе, которая должна образоваться в соответствии с теоретическим расчетом, т. е.
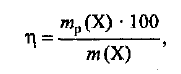
где 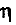 — выход продукта, %;
— выход продукта, %; 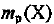 —масса продукта X, полученного в реальном процессе; m (X) — рассчитанная масса вещества X.
—масса продукта X, полученного в реальном процессе; m (X) — рассчитанная масса вещества X.
В тех задачах, где выход продуктов не указан, предполагается, что он количественный (теоретический), т. е. 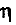 = 100%.
= 100%.
Пример оформления заказа №9
Железо может быть получено восстановлением оксида железа (III) алюминием. Какую массу алюминия и оксида железа (III) надо взять для получения железа массой 140 г?
Решение:
1. Записываем уравнение реакции:
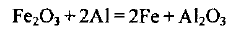
Определяем количество вещества железа, которое надо получить:
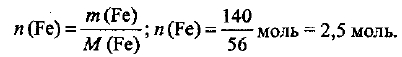
Из уравнения реакции следует, что для получения железа количеством вещества 2 моль требуется 1 моль  и 2 моль алюминия, т. е.
и 2 моль алюминия, т. е.
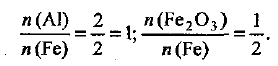
Отсюда получаем:
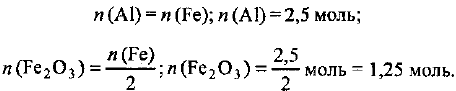
Определяем необходимые массы алюминия и оксида железа (III):
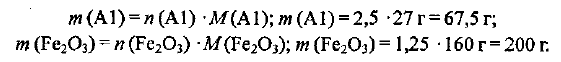
Пример оформления заказа №10
Какой объем водорода выделится при нормальных условиях, если растворить алюминий массой 10,8 г в избытке соляной кислоты?
Решение:
Записываем уравнение реакции взаимодействия алюминия с соляной кислотой:
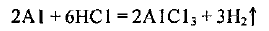
Определяем количество вещества алюминия, вступившего в реакцию:
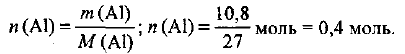
Из уравнения реакции следует, что при растворении 2 моль алюминия образуется 3 моль водорода 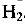 . Следовательно,
. Следовательно,
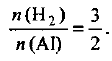
Отсюда следует:
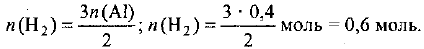
Рассчитываем объем водорода при нормальных условиях:
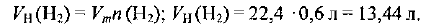
Периодический закон Д.И. Менделеева и строение атомов
Пример оформления заказа №11
В какой группе и в каком периоде периодической системы элементов Д.И. Менделеева находится элемент с порядковым номером 42?
Решение:
Расположение элементов в периодической системе в соответствии со строением их атомов следующее: в первом периоде 2, во втором 8, в третьем 8. Третий период заканчивается элементом с порядковым номером 18 (2 + 8 + 8 — 18). В четвертом периоде 18 элементов, т. е. он заканчивается элементом с порядковым номером 36. В пятом периоде также 18 элементов, поэтому элемент с порядковым номером 42 попадает в пятый период. Он занимает шестое место, следовательно, находится в шестой группе (побочной подгруппе). Этот элемент — молибден Мо.
Пример оформления заказа №12
Какой из элементов — литий или калий — обладает более выраженными металлическими свойствами?
Решение:
Строение электродных оболочек атомов лития и калия представляем следующим образом: 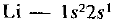 и К —
и К — 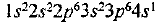 или сокращенно
или сокращенно 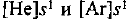 . Как видим, у обоих атомов на внешнем энергетическом уровне находится по одному электрону. Однако у атома калия внешний электрон расположен дальше от ядра (на четвертом энергетическом уровне, а у лития — на втором) и, следовательно, легче отрывается. Поскольку металлические свойства обусловлены способностью отдавать электроны, они сильнее выражены у калия.
. Как видим, у обоих атомов на внешнем энергетическом уровне находится по одному электрону. Однако у атома калия внешний электрон расположен дальше от ядра (на четвертом энергетическом уровне, а у лития — на втором) и, следовательно, легче отрывается. Поскольку металлические свойства обусловлены способностью отдавать электроны, они сильнее выражены у калия.
Пример оформления заказа №13
Опишите химические свойства элемента с порядковым номером 23 по его положению в периодической системе. •
Решение:
По периодической системе определяем, что элемент с порядковым номером 23 находится в четвертом периоде и в побочной подгруппе V группы. Этот элемент — ванадий V. Электронная формула V: 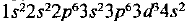 или сокращенно
или сокращенно 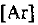
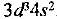 Следовательно, V — d-элемент.
Следовательно, V — d-элемент.
Элемент может легко отдавать 2 электрона с 4-го уровня, проявляя степень окисления +2. При этом он образует оксид VO и гидроксид 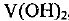 , проявляющие основные свойства. Газообразных водородных соединений ванадий не образует, так как расположен в побочной подгруппе.
, проявляющие основные свойства. Газообразных водородных соединений ванадий не образует, так как расположен в побочной подгруппе.
Атом ванадия может также отдавать электроны с d-подуровня предпоследнего энергетического уровня (3 электрода) и, таким образом, проявлять высшую степень окисления +5 (численно равную номеру группы, в которой расположен элемент). Оксид, соответствующий высшей степени окисления, 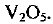 . Этот оксид обладает кислотными свойствами. В качестве гидроксида ему соответствует неустойчивая метаванадиевая кислота
. Этот оксид обладает кислотными свойствами. В качестве гидроксида ему соответствует неустойчивая метаванадиевая кислота 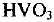 (соли ее — ванадаты — устойчивые соединения).
(соли ее — ванадаты — устойчивые соединения).
Изотопы. Ядерные реакции
Молярной долей вещества называется отношение количества данного вещества к общему количеству вещества системы, т. е.
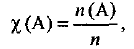
где 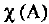 — молярная доля вещества
— молярная доля вещества 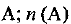 — количество вещества
— количество вещества 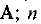 — общее количество вещества системы. Если, например, система состоит из двух веществ А и В, то
— общее количество вещества системы. Если, например, система состоит из двух веществ А и В, то 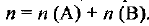 . Молярная доля — безразмерная величина, ее выражают в долях или в процентах.
. Молярная доля — безразмерная величина, ее выражают в долях или в процентах.
При помощи молярной доли показывают, например, содержание изотопов в природе.
Пример оформления заказа №14
Определите относительную атомную массу бора, если известно, что молярная доля изотопа 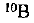 составляет 19,6%, а изотопа
составляет 19,6%, а изотопа 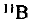 — 80,4%.
— 80,4%.
Решение:
Выбираем для расчетов образец бора с числом атомов N. Тогда общее количество вещества системы (элемента бора) составит:
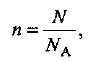
где 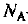 — постоянная Авогадро. Определяем количества веществ изотопов
— постоянная Авогадро. Определяем количества веществ изотопов 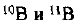
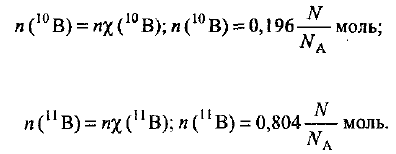
Определяем число атомов 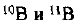 , содержащихся в N атомах бора:
, содержащихся в N атомах бора:
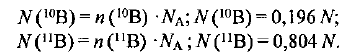
Вычисляем массу атомов 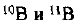 в относительных единицах:
в относительных единицах:
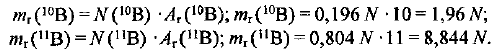
Рассчитываем массу # атомов бора в относительных единицах:
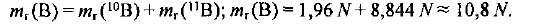
Определяем среднюю относительную массу одного атома бора, т. е. относительную атомную массу химического элемента бора:
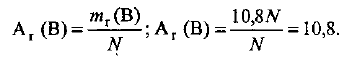
Пример оформления заказа №15
Элемент астат (изотоп 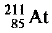 ) был получен облучением изотопа висмута
) был получен облучением изотопа висмута 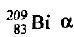 -частицами (ядрами атомов гелия). Напишите уравнение ядерной реакции в полной и сокращенной формах.
-частицами (ядрами атомов гелия). Напишите уравнение ядерной реакции в полной и сокращенной формах.
Решение:
При составлении уравнений ядерных реакций необходимо учитывать закон сохранения массы веществ (масса электронов при этом не учитывается). Кроме того, заряды всех частиц в левой и правой частях уравнения должны быть равны.
В левой части записываем взаимодействующие ядра, в правой — продукты реакции. Учитывая порядковые номера и относительные массы атомов, напишем схему реакции:
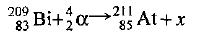
Очевидно, частица х должна иметь заряд 0 (так как 83 + 2 = 85) и атомную массу 209 + 4-211=2. Частица с зарядом 0 — это нейтрон 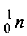 , следовательно, должно образоваться два нейтрона. Окончательный вид уравнения
, следовательно, должно образоваться два нейтрона. Окончательный вид уравнения
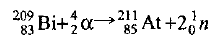
или в сокращенной форме
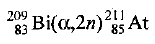
Строение электронных оболочек атомов
Пример оформления заказа №16
Напишите электронную формулу элемента, атом которого содержит на 3 (/-подуровне три электрона. В каком периоде, группе и подгруппе он находится и как этот элемент называется?
Решение:
После завершения подуровня 4s заполняется электронами 3d-подуровень:

Общее число электронов в атоме, которое определяет порядковый номер элемента в периодической системе, — 23. Это ванадий. Из электронной формулы видно, что этот элемент находится в четвертом периоде, V группе (пять валентных электронов: 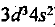 ), побочной подгруппе (элемент (/-семейства).
), побочной подгруппе (элемент (/-семейства).
Пример оформления заказа №17
Составьте электронную формулу и сокращенную электронную формулу элемента с порядковым номером 20. Покажите распределение электронов по орбиталям.
Решение:
По порядковому номеру заключаем: в атоме 20 электронов. Данный элемент— кальций. Электронная формула в соответствии с принципом наименьшей энергии имеет вид
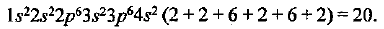
Более компактное написание электронной формулы — ее называют сокращенной электронной формулой — будет 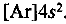 В ней та часть, которая соответствует заполненным электронным уровням благородного газа, обозначается его символом (в квадратных скобках) и рядом изображаются остальные электроны.
В ней та часть, которая соответствует заполненным электронным уровням благородного газа, обозначается его символом (в квадратных скобках) и рядом изображаются остальные электроны.
Электронной формуле кальция соответствует следующее распределение электронов по орбиталям:

Химическая связь. Валентность и степень окисления
Пример оформления заказа №18
Определите, как изменяется прочность соединений в ряду: 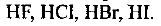
Решение:
У этих двухатомных молекул прочность связи зависит от длины связи. А поскольку радиус атома при переходе от фтора к иоду возрастает, то длина связи Н—галоген в этом направлении возрастает, т.е. прочность соединений при переходе от фтора к иоду уменьшается.
Пример оформления заказа №19
Сера образует химические связи с калием, водородом, бромом и углеродом. Какие из связей наиболее и наименее полярны? Укажите, в сторону какою атома происходит смещение электронной плотности связи.
Решение:
Используя значения относительных электроотрицательностей элементов, находим разности относительных электроотрицательностей серы и элементов, образующих с нею химическую связь:
а) сера — калий: 2,6 — 0,91 = 1,69, смещение в сторону атома серы;
б) сера — водород: 2,6 серы;
в) сера — бром: 2,6 —: брома;
г) сера — углерод: 2,6 — 2,5 = 0,1, смещение в сторону атома серы.
Чем больше по абсолютному зпачению разность относительных электроотрицательностей, тем более полярна связь. В данном примере наиболее полярной является связь сера — калий, наименее полярной — связь сера — углерод.
2,1 = 0,5, смещение в сторону атома
2,74 — -0,14, смещение в сторону атома
Скорость химических реакций, химическое равновесие
Пример оформления заказа №20
В сосуде объемом 2 л смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А + В = С. Через 20 с в системе образовался газ С количеством вещества 2 моль. Определите среднюю скорость реакции. Какие количества не прореагировавших газов А и В остались в системе?
Решение:
Из уравнения реакции следует, что
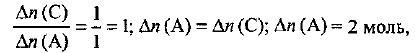
где 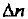 изменение количества вещества в ходе реакции.
изменение количества вещества в ходе реакции.
Аналогично получаем, что
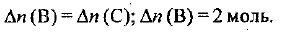
Следовательно, в сосуде осталось:
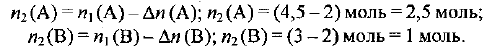
Согласно определению, скорость реакции равна:
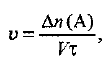
где 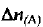 изменение количества вещества, участвующего в реакции; V — объем системы;
изменение количества вещества, участвующего в реакции; V — объем системы; 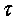 — время реакции.
— время реакции.
Определяем скорость реакции:
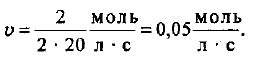
Пример оформления заказа №21
В системе
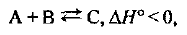
где А, В и С — газы, установилось равновесие. Какое влияние на равновесное количество вещества С в единице объема системы окажут: а) увеличение давления; б) увеличение количества вещества А в системе; в) повышение температуры?
Решение:
а) При протекании реакции общее количество вещества газообразных веществ уменьшается (с 2 моль до 1 моль). В соответствии с принципом Ле Шателье повышение давления приведет к смещению равновесия в сторону реакции, приводящей к меньшему количеству вещества газов, т. е. в сторону вещества С. Следовательно, 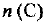 увеличивается.
увеличивается.
б) При увеличении 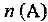 равновесие будет смещаться в сторону реакции, которая уменьшает
равновесие будет смещаться в сторону реакции, которая уменьшает 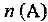 , т. е. в сторону образования продукта С. Следовательно,
, т. е. в сторону образования продукта С. Следовательно, 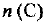 увеличится.
увеличится.
в) Так как 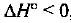 , то теплота выделяется в ходе прямой реакции, она является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т. е. равновесие сместится в сторону веществ А и В, и
, то теплота выделяется в ходе прямой реакции, она является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т. е. равновесие сместится в сторону веществ А и В, и 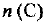 уменьшится.
уменьшится.
Растворы. Электролитическая диссоциация. Массовая доля компонента раствора
Пример оформления заказа №22
Какую массу фосфата калия и воды надо взять для приготовления раствора с массовой долей К1ГО4 8% массой 250 г?
Решение:
Используя формулу (1.2), определяем, какая масса соли потребуется для приготовления раствора с 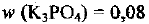 (8%) массой 250 г:
(8%) массой 250 г:

Находим массу воды, необходимую для приготовления раствора:
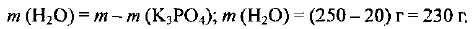
Пример оформления заказа №23
В воде объемом 200 мл растворили соль массой 40 г. Определите массовую долю соли в полученном растворе, приняв плотность воды равной 1 г/мл.
Решение:
Определяем массу растворителя (воды):
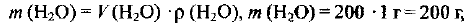
где 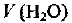 — объем воды;
— объем воды; 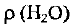 — ее плотность.
— ее плотность.
Масса полученного раствора составляет:
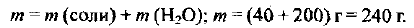
Рассчитываем массовую долю соли в растворе:
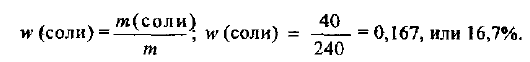
Объемная доля растворенного вещества
Пример оформления заказа №24
К метиловому спирту массой 32 г и плотностью 0,8 г/мл добавили воду до объема 80 мл. Определите объемную долю спирта в растворе.
Решение:
Рассчитаем объем растворенного спирта:
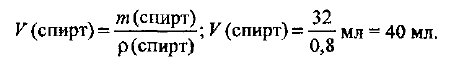
Определяем объемную долю спирта в растворе, используя формулу (1.5):
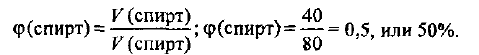
Пример оформления заказа №25
При смешении воды объемом 50 мл и плотностью 1 г/мл и метилового спирта объемом 70 мл и плотностью 0,8 г/мл получим раствор с плотностью 0,9 г/мл. Определите объемную долю метилового спирта в растворе.
Решение:
При смешении веществ объем раствора не равен сумме объемов растворенного вещества и растворителя. Поэтому вначале необходимо вычислить массу раствора.
Определяем массу воды:
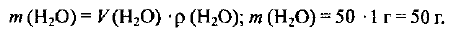
Находим массу метилового спирта:
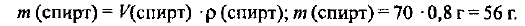
Масса раствора составляет:
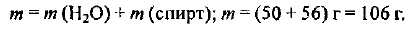
Определяем объем раствора:
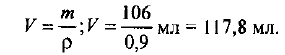
Рассчитываем объемную долю метилового спирта:
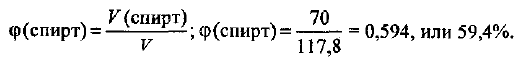
Молярная концентрация
Молярная концентрация —это отношение количества растворенного вещества к объему раствора, т. е.
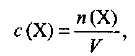
где 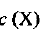 — молярная концентрация вещества
— молярная концентрация вещества 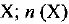 — количество растворенного вещества X; V — объем раствора. Единица СИ молярной концентрации — моль/м3, однако чаще используется единица моль/л.
— количество растворенного вещества X; V — объем раствора. Единица СИ молярной концентрации — моль/м3, однако чаще используется единица моль/л.
Единицу молярной концентрации обозначают буквой М. Например, запись 0,2М означает, что молярная концентрация равна 0.2 моль/л.
Пример оформления заказа №26
В воде растворили гидроксид калия массой 11,2 г, объем раствора довели до 200 мл. Определите молярную концентрацию полученного раствора.
Решение:
Рассчитаем количество вещества растворенного гидроксида калия:
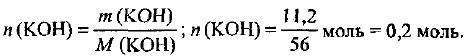
Определяем молярную концентрацию раствора, используя формулу (4.1):
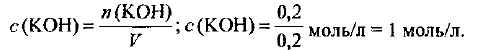
Пример оформления заказа №27
Определите молярную концентрацию раствора, полученного при растворении сульфата натрия массой 42,6 г в воде массой 300 г, если плотность полученного раствора равна 1,12 г/мл.
Решение:
Определите массу полученного раствора:
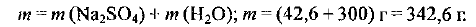
Рассчитаем объем раствора:
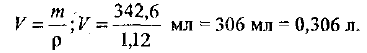
Количество вещества сульфата натрия равно:
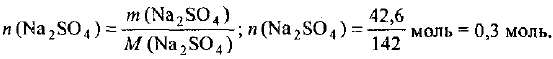
Определяем молярную концентрацию раствора:
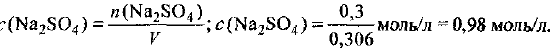
Растворимость
Пример оформления заказа №28
Коэффициент растворимости хлорида аммония при температуре 15 °C равен 35 г. Определите массовую долю хлорида аммония в насыщенном при температуре 15 °C растворе.
Решение:
Коэффициент растворимости показывает, что при температуре 15 °C в воде массой 100 г растворяется хлорид аммония массой 35 г.
Выбираем для расчетов образец раствора, который содержит воду массой 100 г. Тогда масса растворенной соли будет составлять 35 г.
Находим массу раствора:
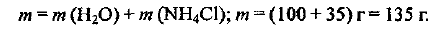
Определяем массовую долю хлорида аммония:

Химические реакции в растворах электролитов
Пример оформления заказа №29
Составьте уравнения реакций, протекающих в водных растворах, в молекулярной, ионной и сокращенной ионной формах: 1) между сульфидом натрия и сульфатом меди (II); 2) между сульфатом железа (Ill) и гидроксидом натрия.
Решение:
1. Решение задачи разобьем на этапы:
а) составляем уравнение реакции в молекулярной форме:
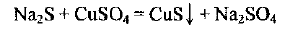
б) составляем уравнение реакции в ионной форме, изобразив формулы растворимых сильных электролитов в виде ионов, на которые они диссоциируют практически полностью, а формулы остальных веществ (например, выпадающих в осадок) оставим без изменении. При составлении ионного уравнения необходимо использовать таблицу растворимости солей и оснований в воде. В нашем примере получаем
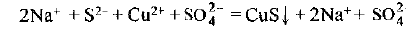
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты)

г) записываем уравнение в сокращенной ионной форме:
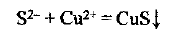
- Действуем поэтапно, как и в предыдущем примере:
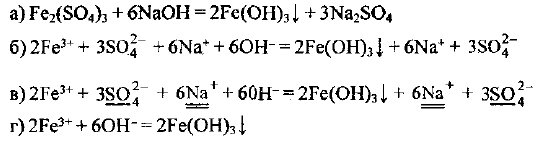
Разделив все коэффициенты в уравнении на 2, окончательно получаем
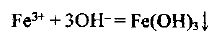
Расчеты по уравнениям реакций, протекающих в растворах
Пример оформления заказа №30
Какая масса раствора с массовой долей гидроксида натрия 4% потребуется для полной нейтрализации соляной кислоты массой 30 г с массовой долей НС1 5%?
Решение:
Составляем уравнение реакции, протекающей в растворе:
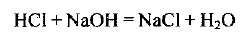
Определяем массу и количество вещества хлороводорода, содержащегося в растворе соляной кислоты:

Из уравнения реакции следует:
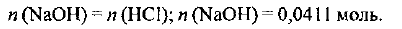
— количество вещества гидроксида натрия, которое потребуется для реакции.
Вычисляем массу требуемого гидроксида натрия:
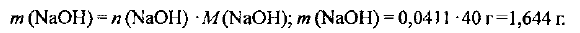
Определяем необходимую массу 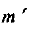 раствора гидроксида натрия с
раствора гидроксида натрия с 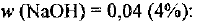
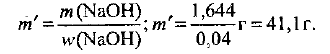
Возможно эти страницы вам будут полезны:

