Оглавление:



Серная кислота
- Серная кислота Повторите из главы 2 § 4. Электронная и структурная формула серной кислоты: н: б:| 0:н-УР оч Н: О: К *и-0 ′ Мы получили ваши отзывы. Серная кислота образуется при взаимодействии оксида серы (VI) с водой. Его продукция рассмотрена на 167 страницах.
- Физические характеристики. Серная кислота представляет собой бесцветную тяжелую (Р = 1,84 г / см3) нелетучую жидкость. Если к концентрированной серной кислоте добавить воду, то часть воды, почти в 2 раза легче серной кислоты, не успевает смешаться с серной кислотой и нагревается до кипения.
При растворении в воде происходит очень сильный нагрев. Людмила Фирмаль
Пары воды могут вызвать кислотные брызги, попасть в глаза, попасть на кожу и получить ожог. Не поливайте концентрированную серную кислоту. Если вам нужно разбавить концентрированную серную кислоту, влейте ее в воду тонкой струйкой, постоянно помешивая. Концентрированная серная кислота поглощает водяной пар из воздуха.
Это можно увидеть, когда открытая емкость с концентрированной серной кислотой уравновешивается балансовым балансом. Через некоторое время чашка с контейнером падает. Химическое свойство. Разбавленная серная кислота обладает общими свойствами, характерными для всех acids. In кроме того, серная кислота обладает определенными свойствами (таблица 34).
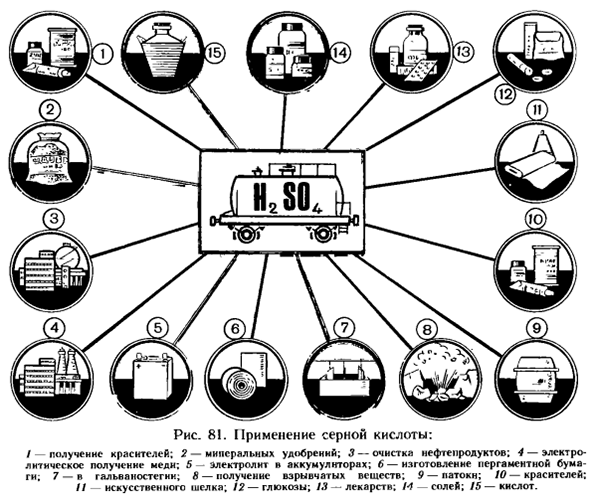
Применение серной кислоты и ее солей. Благодаря своим свойствам (способность поглощать воду, окислительные свойства, нелетучие) серная кислота широко применяется Таблица 34 Химические свойства серной кислоты Характерные для других кислот 1.Водный раствор изменяет цвет индикатора 2.
Разбавленная серная кислота вступает в реакцию с металлами: H2S04 + Zn — * — ZnS04 + H2f 3.Реагирует с основными и амфотерными оксидами: H, S04 + MgO MgS04 +Н2®H2S04 + ZnO — » — ZnS04 + H2O 4.Взаимодействие с основаниями: HjSO,+ 2KOH-K * S04 +2HaO3H2S04 + 2fe (0H) 3- * Fe2 (S04) 3+6н20.При чрезмерном использовании кислоты образуется кислотная соль: HjS04 + NaOH NaHS04 + H20 5.
Реагирует с солью и заменяет другие кислоты: 3H2S04 4-Ca3 (P04) g — • * 3CaS04 +2Н3Р041.Концентрированная серная кислота является сильным окислителем. При нагревании он вступает в реакцию практически со всеми металлами(за исключением Au, Pt и некоторых других). S02 и H2S различаются следующим образом reactions. Cu+ 2H2S04 CuS04 + S02f +2Н202.
- Концентрированная серная кислота бурно реагирует с водой с образованием гидратов: H2S04 + / iH20 — * H2S04. концентрированная серная кислота nH20 + Q способна удалять водород и кислород из органических веществ в виде воды и обжигать их.3.Характерной реакцией серной кислоты и ее солей является взаимодействие растворимых солей бария: H2S04 + BaC12 BaS04 2HCI белый осадок, который не растворяется ни в воде, ни в концентрированной азотной кислоте.
Мистер эконом. Относится к основным продуктам химической промышленности. Приложение показано на рисунке 81. Серная кислота образует 2 ряда солей-среднюю и кислую: Na2S04 NaHSO、 Гидросульфит натрия сульфат (Средняя соль) натрий (Кислотная соль) Сульфаты широко используются.
Na2S04 * UN20-кристаллогидрат сульфата натрия (соль граувера) — необходим для производства соды, стекла, фармацевтических препаратов и ветеринарной медицины. Людмила Фирмаль
CaS04•2NgO-кристаллогидрат сульфата кальция (природный гипс) — широко используется для получения полуводной штукатурки, необходимой для construction. In медицина, она использована для применения Шлихт гипса. CuS04•5Н20-кристаллогидрат сульфата меди (II) (купорос) — применяется в борьбе с вредителями и болезнями растений. Ответьте на вопросы, упражнение 12-16 (стр. 173).Решите задачи 4 и 5(стр. 174). Рисунок 81.
Применение серной кислоты: / Получение красителей; 2-минеральные удобрения; 3-переработка нефтепродуктов; 4-электролитическое производство меди; 5-электролит в аккумуляторах; 6-производство пергамента; 7-гальванопокрытие. 8-получение взрывчатых веществ. 9-латокс; 10-краситель: II искусственный шелк;12-глюкоза; 13-Лекарство; и соль; 15-кислота.
Смотрите также:
| Оксид серы (IV) | Скорость химических реакций и ее зависимость от условий протекания |
| Оксид серы (VI) | Обратимость химических реакций. Химическое равновесие |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.

