Оглавление:

Здравствуйте, на этой странице я собрала краткий курс лекций по предмету «химия».
Эти краткие лекции подготовлены для школьников и студентов любых специальностей.
В лекциях вы найдёте основные законы, теоремы, формулы и примеры задач с подробным решением.
| Если что-то непонятно — вы всегда можете написать мне в WhatsApp и я вам помогу! |
Химия — это одна из важнейших и обширных областей естествознания, наука, изучающая вещества, также их состав и строение, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям способны формировать молекулы, то химия занимается, прежде всего, рассмотрением перечисленных выше задач на атомно-молекулярном уровне, то есть на уровне химических элементов и их соединений. Химия имеет немало связей с физикой и биологией, по сути граница между ними условна, а пограничные области изучаются квантовой химией, химической физикой, физической химией, геохимией, биохимией и другими науками. wikipedia.org/wiki/Химия
Введение в химию
Химия является одной из фундаментальных естественнонаучных дисциплин. Это значит, что она описывает мир на определённом уровне строения материи, а именно на атомно-молекулярном, в ней рассматриваются лишь вещества определенного состава (химические вещества) и превращения этих веществ (химические превращения, реакции). Понимание проблем и процессов на атомно-молекулярном уровне необходимо для инженера любой специальности, поскольку ему обязательно приходится иметь дело с различными веществами, материалами и химическими реакциями. Как всякая фундаментальная наука, она вооружает техникой решения специфических (в данном случае − химических) задач.
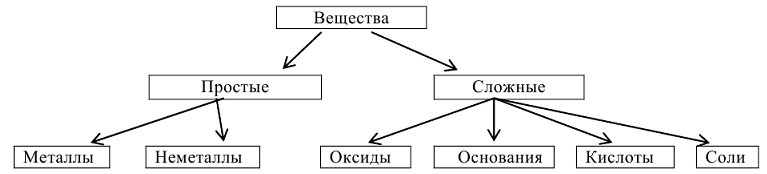
Основные классы неорганических соединении
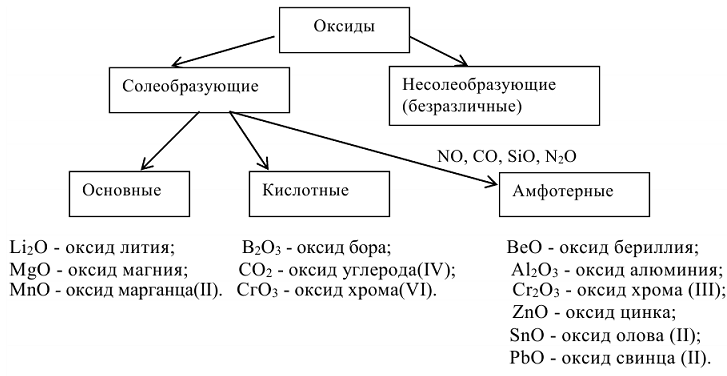
Неорганические соединения могут классифицироваться как по составу, так и по свойствам. По составу они подразделяются на простые вещества, состоящие из атомов одного и того же элемента 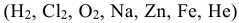 и сложные вещества, которые состоят из атомов разных элементов
и сложные вещества, которые состоят из атомов разных элементов 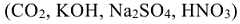
Классификация основных классов неорганических соединений.
Оксиды — бинарные соединения элементов с кислородом. Общая формула оксидов 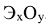 . Название оксидов состоит соответственно из слова «оксид» плюс название элемента в родительном падеже. Если элемент проявляет переменную степень окисления, то в скобках дополнительно указывают степени окисления элемента:
. Название оксидов состоит соответственно из слова «оксид» плюс название элемента в родительном падеже. Если элемент проявляет переменную степень окисления, то в скобках дополнительно указывают степени окисления элемента: 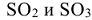 соответственно оксиды серы (IV) и (VI).
соответственно оксиды серы (IV) и (VI).
СВОЙСТВА ОКСИДОВ:
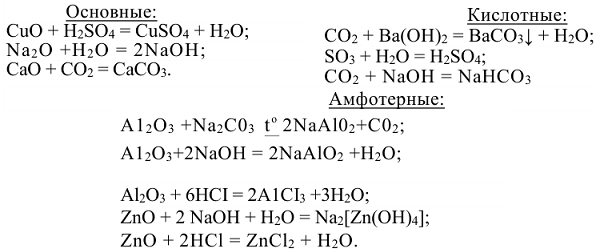
Основания — химические соединения, которые в растворе диссоциируют с образованием гидроксид-ионов 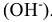 Название оснований состоит из слова «гидроксид» плюс название металла в родительном падеже. Если металл проявляет переменную степень окисления, то в скобках после названия металла указывается степень его окисления число гидроксид-ионов определяет кислотность основания.
Название оснований состоит из слова «гидроксид» плюс название металла в родительном падеже. Если металл проявляет переменную степень окисления, то в скобках после названия металла указывается степень его окисления число гидроксид-ионов определяет кислотность основания.
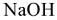 — гидроксид натрия (однокислотное основание);
— гидроксид натрия (однокислотное основание);
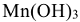 — гидроксид марганца (III) (трехкислотное основание);
— гидроксид марганца (III) (трехкислотное основание);
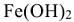 — гидроксид железа (II) (двухкислотные основания);
— гидроксид железа (II) (двухкислотные основания);
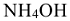 — гидроксид аммония.
— гидроксид аммония.
Свойства оснований
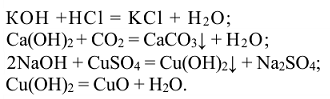
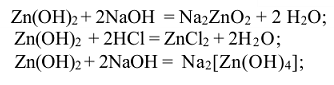
Кислоты — химические соединения, содержащие атомы водорода, способные замещаться атомами металлов. С позиций теории электролитической диссоциации к кислотам относятся вещества, способные диссоциировать в растворе с образованием ионов водорода 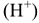
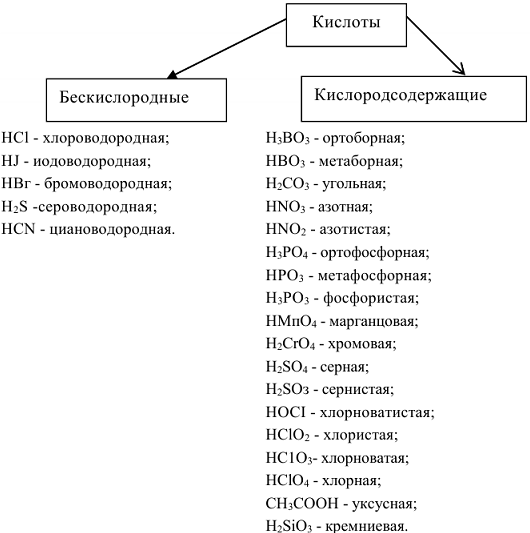
Название кислот производят от названия элементов, которые их образовали. В случае бескислородных кислот к названию элемента добавляют слово «водородная». 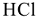 -хлороводородная,
-хлороводородная, 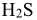 — сероводородная,
— сероводородная, 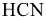 — циановодородная. Если элемент образует две кислородсодержащие кислоты
— циановодородная. Если элемент образует две кислородсодержащие кислоты 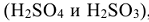 , то их названия отличаются окончанием: (н)ая и — (н)истая. Первое соответствует кислотам, в которых элемент образовавший кислоту, находится в высшей степени окисления, второе, соответствует кислотам, в которых элемент находится в промежуточной степени окисления (
, то их названия отличаются окончанием: (н)ая и — (н)истая. Первое соответствует кислотам, в которых элемент образовавший кислоту, находится в высшей степени окисления, второе, соответствует кислотам, в которых элемент находится в промежуточной степени окисления (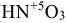 — азотная,
— азотная, 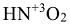 — азотистая). Количество атомов водорода, которые способны замещаться на атомы металла определяет основность кислоты (
— азотистая). Количество атомов водорода, которые способны замещаться на атомы металла определяет основность кислоты (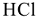 — одноосновная,
— одноосновная, 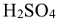 — двухосновная,
— двухосновная, 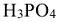 — трехосновная).
— трехосновная).
В зависимости от числа молекул воды к названию кислоты прибавляется приставка орто-, или мета-. При максимальном количестве воды добавляется приставка орто-, а при минимальном количестве воды приставка мета-. Кислота 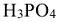 в которой на одну молекулу фосфорного ангидрида
в которой на одну молекулу фосфорного ангидрида 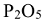 приходится три молекулы воды, называются ортофосфорной, а кислота
приходится три молекулы воды, называются ортофосфорной, а кислота 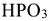 мстафосфорной.
мстафосфорной.
Свойства кислот
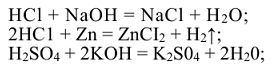
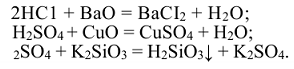
Соли — сложные вещества, которые являются продуктами полного или частичного замещения ионов водорода кислоты ионами металла или гидроксид-ионов основания кислотными остатками. Одним из способов получения солей является взаимодействие кислот и оснований.
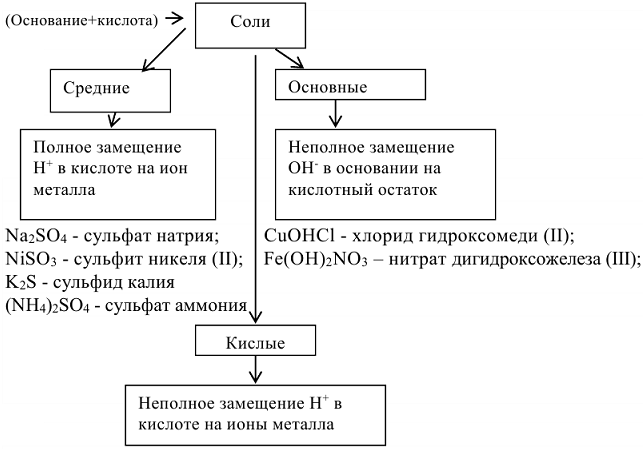
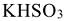 — гидросульфит калия;
— гидросульфит калия;
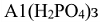 — дигидроортофосфат алюминия.
— дигидроортофосфат алюминия.
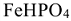 — гидроортофосфат железа (II). Название важнейших кислот и солей (табл. П1).
— гидроортофосфат железа (II). Название важнейших кислот и солей (табл. П1).
Свойства солей
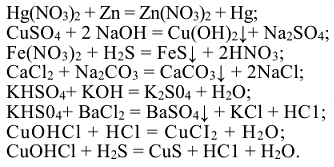
При написании формул химических соединений следует учитывать, что:
- Степень окисления атомов в простых веществах равна нулю. Например:
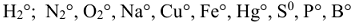 и др.
и др. - Атомы кислорода в соединениях проявляют степень окисления (-2). Например:
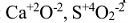 и т.д. Исключения: фторид кислорода
и т.д. Исключения: фторид кислорода 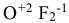 — степень окисления кислорода (+2), пероксиды -степень окисления кислорода
— степень окисления кислорода (+2), пероксиды -степень окисления кислорода 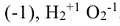 .
. - Для водорода степень окисления равна (+ 1). Например:
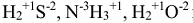 и т.д.
и т.д.
Исключения: гидриды металлов типа 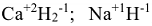 ; в которых степень окисления водорода (-1).
; в которых степень окисления водорода (-1).
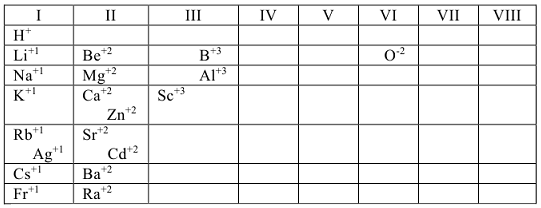
4. Элементы, имеющие постоянную степень окисления в большинстве соединений
5. Алгебраическая сумма степеней окисления отдельных атомов, образующих молекулу, с учетом стехиометрических индексов равна нулю. Например, можно определить степень окисления азота в молекуле  , зная степени окисления кислорода (-2) и водорода (+1):
, зная степени окисления кислорода (-2) и водорода (+1): 
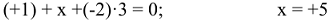
или степень окисления хрома в молекуле 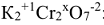 :
:
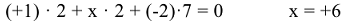
6. Атомы одного и того же элемента в различных соединениях могут иметь различные степени окисления, например:
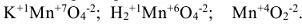
Эквивалент
Любое вещество состоит из формульных единиц (ФЕ). Формульные единицы — это реально существующие частицы, такие как атомы, молекулы, ионы, радикалы (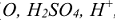 ,
, 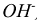 ).
).
Единицей количества вещества в химии является моль. Моль — это такое количество вещества, которое содержит столько формульных единиц, сколько атомов содержится в 0,012 кг изотопа углерода 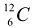 . В 0,012 кг изотопа
. В 0,012 кг изотопа 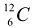 содержится
содержится 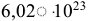 атомов. Число
атомов. Число 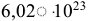 моль
моль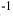 — постоянная Авогадро
— постоянная Авогадро 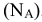 .
.
Количество вещества равно
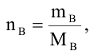
где 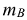 — масса вещества, г.
— масса вещества, г.
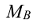 — молярная масса вещества, г/моль.
— молярная масса вещества, г/моль.
Так как в реакции могут вступать не только реальные, но и условные частицы, равноценные 1 атому или 1 иону водорода, то кроме формульных единиц в химии применяется также понятие «эквивалент».
Эквивалент — это реальные или условные частицы вещества, в 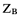 раз меньшие чем соответствующие им формульные единицы, или условные частицы, которые в кислотноосновных реакциях равноценны одному атому или одному иону водорода, а в окислительно-восстановительных реакциях одному отданному или принятому электрону.
раз меньшие чем соответствующие им формульные единицы, или условные частицы, которые в кислотноосновных реакциях равноценны одному атому или одному иону водорода, а в окислительно-восстановительных реакциях одному отданному или принятому электрону.
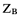 — число эквивалентности или эквивалентное число. Число моль эквивалентов вещества обозначается
— число эквивалентности или эквивалентное число. Число моль эквивалентов вещества обозначается 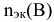 .
.
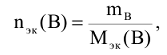
где 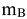 — масса вещества, г.
— масса вещества, г.
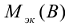 — молярная масса эквивалента вещества, г/моль.
— молярная масса эквивалента вещества, г/моль.
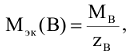
где 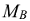 — молярная масса вещества, г/моль.
— молярная масса вещества, г/моль.
Численное значение молярной массы эквивалента элемента равно отношению молярной массы атома элемента к его валентности (В).
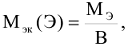
Например: 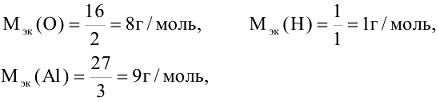
Элементы, имеющие переменную валентность, имеют различные значения молярных масс эквивалентов элементов 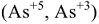
Например:
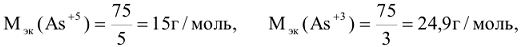
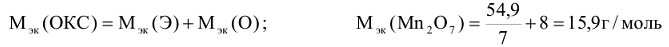

где n — число атомов элемента, В-валентность элемента.
Молярные массы эквивалентов сложных веществ могут иметь различные значения в зависимости от того, в какую реакцию вступает данное вещество. Так, например, молярная масса эквивалента кислоты (основания) равна молярной массе кислоты (основания) 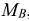 , деленной для кислоты на число атомов водорода, замещенных в данной реакции на металл, а для основания — на число гидроксогрупп, замещенных в данной реакции на кислотный остаток.
, деленной для кислоты на число атомов водорода, замещенных в данной реакции на металл, а для основания — на число гидроксогрупп, замещенных в данной реакции на кислотный остаток.
Например:
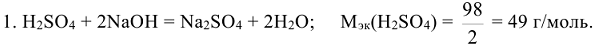
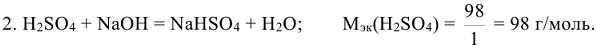
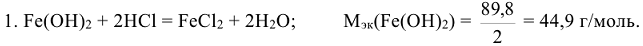
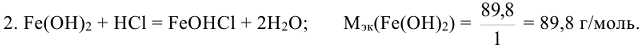
Молярная масса эквивалента соли:
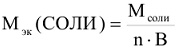
Например: 
где n — число атомов металла в молекуле соли. В — валентность этого металла.
Возможно эта страница вам будет полезна:
| Решение задач по химии |
Закон эквивалентов
Вещества вступают в реакцию в эквивалентных количествах.
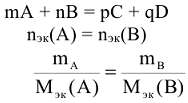
Массы (объемы) реагирующих друг с другом веществ, пропорциональны молярным
массам их эквивалентов (объемам молярных масс эквивалентов).
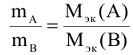
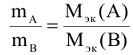 , если вещества А и В — твердые.
, если вещества А и В — твердые.
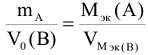 , если вещество А — твердое, а В — газообразное.
, если вещество А — твердое, а В — газообразное.
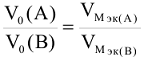 , если оба вещества газообразные,
, если оба вещества газообразные,
где 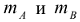 — массы веществ А и В, г.
— массы веществ А и В, г.
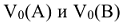 — объемы газообразных веществ А и В при нормальных условиях, л.
— объемы газообразных веществ А и В при нормальных условиях, л.
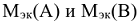 — молярные массы эквивалентов веществ А и В, г/моль.
— молярные массы эквивалентов веществ А и В, г/моль.
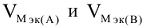 — объемы молярных масс эквивалентов (эквивалентные объемы) газообразных веществ А и В, л/моль.
— объемы молярных масс эквивалентов (эквивалентные объемы) газообразных веществ А и В, л/моль.
Эквивалентный объем газообразного вещества 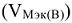 — это объем молярной массы эквивалента данного вещества при нормальных условиях (н.у.)
— это объем молярной массы эквивалента данного вещества при нормальных условиях (н.у.)
Например: 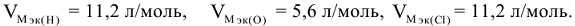
Способы выражения состава раствора
Раствор — однородная система переменного состава. Растворы бывают жидкими, твердыми, газообразными.
Концентрация (состав раствора) — отношение количества или массы вещества, содержащегося в системе к объему или массе той же системы. Наиболее распространены следующие способы выражения состава растворов.
Молярная концентрация вещества или молярность (символ Св, размерность-моль/л сокращенное обозначение (М)). Выражается числом моль растворенного вещества в 1 литре раствора:
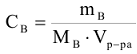
где 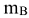 — масса растворенного вещества, г
— масса растворенного вещества, г
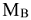 — молярная масса растворенного вещества, г/моль.
— молярная масса растворенного вещества, г/моль.
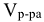 — объем раствора, л.
— объем раствора, л.
Пример 1:
Определить молярную концентрацию раствора, содержащего 14 г КОН в 500 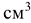 раствора.
раствора.
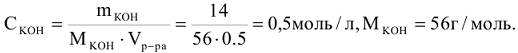
Молярная концентрация эквивалентов вещества или нормальность (символ 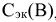 размерность — моль/л сокращенное обозначение (н)). Выражается числом моль эквивалентов растворенного вещества в 1 литре раствора:
размерность — моль/л сокращенное обозначение (н)). Выражается числом моль эквивалентов растворенного вещества в 1 литре раствора:
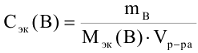
где 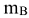 — масса растворенного вещества, г
— масса растворенного вещества, г
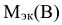 — молярная масса эквивалентов растворенного вещества, г/моль
— молярная масса эквивалентов растворенного вещества, г/моль
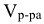 — объем раствора, л.
— объем раствора, л.
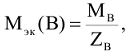
где 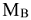 — молярная масса растворенного вещества, г/моль
— молярная масса растворенного вещества, г/моль
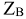 -эквивалентное число, которое определяется: для кислот
-эквивалентное число, которое определяется: для кислот
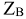 — основность кислоты
— основность кислоты
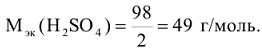
для оснований
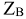 — кислотность оснований
— кислотность оснований
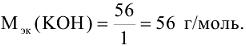
для солей
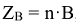
n-число атомов металла в молекуле соли
В — валентность металла
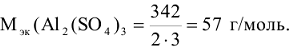
Пример 2:
Сколько граммов 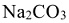 содержится в 500
содержится в 500 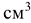 0,1н раствора.
0,1н раствора.
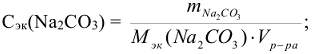
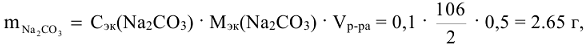
где 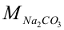 = 106 г/моль.
= 106 г/моль.
Моляльность вещества в растворе или моляльность раствора (символ 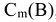 , размерность моль/кг). Выражается числом моль растворенного вещества в 1 кг растворителя (воды):
, размерность моль/кг). Выражается числом моль растворенного вещества в 1 кг растворителя (воды):
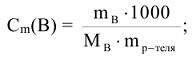
где 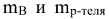 — масса растворенного вещества и растворителя, г., Мв — молярная масса растворенного вещества, г/моль.
— масса растворенного вещества и растворителя, г., Мв — молярная масса растворенного вещества, г/моль.
Пример 3:
Определить моляльность вещества в водном растворе, если в 100 г этого раствора, содержится 8 г NaOH.
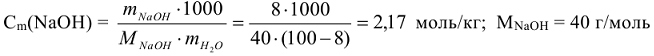
Массовая доля растворенного вещества (символ сов, единица измерения — доля от единицы или процент). Определяется отношением массы растворенного вещества (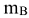 )к массе раствора (
)к массе раствора (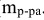 )
)

Масса раствора (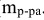 ) связана с объемом раствора (
) связана с объемом раствора (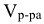 ) следующей формулой:
) следующей формулой:
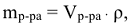
где 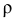 — плотность раствора, г/
— плотность раствора, г/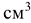 ,
, 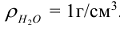
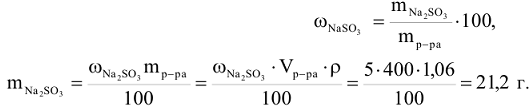
Пример 4:
Сколько граммов 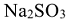 потребуется для приготовления 400
потребуется для приготовления 400 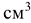 5%-ного раствора, плотность которого
5%-ного раствора, плотность которого 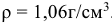
Молярная доля растворенного вещества (символ 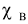 . безразмерная величина).Определяется как отношение числа моль растворенного вещества (
. безразмерная величина).Определяется как отношение числа моль растворенного вещества (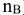 ) к сумме числа моль растворенного вещества (
) к сумме числа моль растворенного вещества (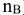 ) и числа моль растворителя (воды).
) и числа моль растворителя (воды).
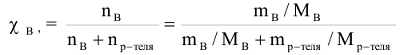
где 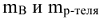 — массы растворенного вещества и растворителя, г;
— массы растворенного вещества и растворителя, г;
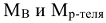 — молярные массы растворенного вещества и растворителя, г/моль.
— молярные массы растворенного вещества и растворителя, г/моль.
Пример 5:
Определить молярную долю глюкозы 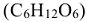 в водном растворе с массовой долей 36%.
в водном растворе с массовой долей 36%.
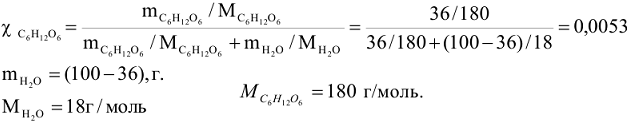
Титр раствора вещества (символ  , размерность г/
, размерность г/ ) Это концентрация стандартного раствора, равная массе растворенного вещества (
) Это концентрация стандартного раствора, равная массе растворенного вещества (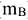 ), содержащейся в 1
), содержащейся в 1 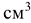 раствора.
раствора.
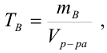
где 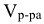 — объем раствора,
— объем раствора, 
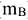 — масса растворенного вещества, г
— масса растворенного вещества, г
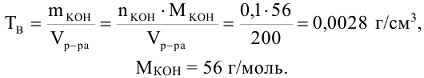
Пример 6:
Определить титр раствора, если в 200  этого раствора содержится 0,1 моль КОН.
этого раствора содержится 0,1 моль КОН.
Возможно эта страница вам будет полезна:
| Решение задач по аналитической химии |
Энергетика химических процессов
При химических процессах происходит изменение свойств систем, которые сопровождаются изменением энергии в виде теплоты (Q) или работы (W). Согласно первому началу термодинамики, теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии 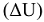 и на совершение работы при условии, что W является работой расширения:
и на совершение работы при условии, что W является работой расширения: 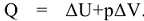 . Теплоты химических превращений, протекающих при постоянных значениях р и V,
. Теплоты химических превращений, протекающих при постоянных значениях р и V, 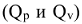 называются тепловыми эффектами реакций, а раздел химии, который их изучает, называется термохимией.
называются тепловыми эффектами реакций, а раздел химии, который их изучает, называется термохимией.
Основным законом термохимии является закон Гесса: «Тепловой эффект химической реакции нс зависит от пути ее протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции». Если реакция протекает с выделением теплоты, то она называется экзотермической, а если с поглощением — эндотермической.
В термохимии принято, что Qp равна по величине изменению энтальпии (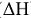 ) с обратным знаком, т.е.
) с обратным знаком, т.е. 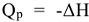 . Согласно первому началу термодинамики, количество теплоты, переданное от одной системы к другой или выделенное в результате химических процессов, определяется как
. Согласно первому началу термодинамики, количество теплоты, переданное от одной системы к другой или выделенное в результате химических процессов, определяется как 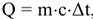 , где m — масса системы, г; с — удельная теплоемкость, Дж/(г К);
, где m — масса системы, г; с — удельная теплоемкость, Дж/(г К); 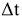 — изменение температуры. При помощи этих уравнений можно определить стандартную теплоту растворения веществ, теплоту нейтрализации и другие тепловые эффекты химических реакций.
— изменение температуры. При помощи этих уравнений можно определить стандартную теплоту растворения веществ, теплоту нейтрализации и другие тепловые эффекты химических реакций.
Для сравнения изменений энтальпий различных процессов их относят к условиям, принятым за стандартные: 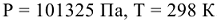
Из закона Гесса вытекают два следствия. Первое следствие: «Изменение энтальпии химической реакции равно сумме стандартных энтальпий образования 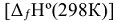 продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов этих веществ в уравнениях реакций». Например: для реакции
продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов этих веществ в уравнениях реакций». Например: для реакции 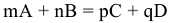 :
:
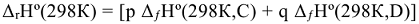 —
— 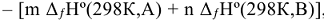 , где m, n, р, q — стехиометрические коэффициенты в уравнении реакции.
, где m, n, р, q — стехиометрические коэффициенты в уравнении реакции.
Второе следствие из закона Гесса: «Изменение энтальпии химической реакции равно сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов 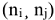 в уравнении реакции:
в уравнении реакции: 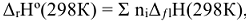 исх —
исх — 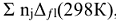 , прод».
, прод».
Стандартные энтальпии образования и сгорания веществ являются табличными величинами (табл.ПЗ). Стандартные энтальпии образования простых веществ (например, 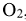 ,
, 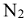 , Fe и т.д.) равны нулю.
, Fe и т.д.) равны нулю.
Изменение энтальпии химической реакции не может определять направление протекания процесса. Согласно II началу термодинамики, в изолированных системах самопроизвольно протекают процессы, идущие с увеличением энтропии системы. Для сравнения энтропий различных веществ, а также определения изменения энтропии системы, их относят к стандартным условиям 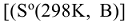 . В отличие от стандартных энтальпий образования простых веществ, их стандартные энтропии нс равны нулю и всегда положительны, т.к. при температурах выше О К всегда существует движение молекул или атомов, определяющих меру беспорядка в системе. Энтропия, также как энтальпия, является функцией состояния, поэтому изменение энтропии системы в результате химической реакции равно сумме стандартных энтропий продуктов реакции за вычетом суммы стандартных энтропий исходных веществ с учетом их стехиометрических коэффициентов
. В отличие от стандартных энтальпий образования простых веществ, их стандартные энтропии нс равны нулю и всегда положительны, т.к. при температурах выше О К всегда существует движение молекул или атомов, определяющих меру беспорядка в системе. Энтропия, также как энтальпия, является функцией состояния, поэтому изменение энтропии системы в результате химической реакции равно сумме стандартных энтропий продуктов реакции за вычетом суммы стандартных энтропий исходных веществ с учетом их стехиометрических коэффициентов 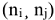 в уравнении реакции:
в уравнении реакции: 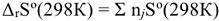 , прод. —
, прод. — 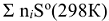 , исх.
, исх.
Функцией состояния, одновременно отражающей влияние энтропии и энтальпии на направление протекания химических процессов, является энергия Гиббса 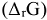 . Энергия Гиббса для химической реакции может быть определена как:
. Энергия Гиббса для химической реакции может быть определена как:
1) 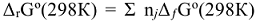 , прод. —
, прод. — 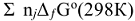 , исx., где
, исx., где 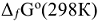 — стандартная энергия Гиббса образования веществ; n,, п, — стехиометрические коэффициенты в уравнении реакции;
— стандартная энергия Гиббса образования веществ; n,, п, — стехиометрические коэффициенты в уравнении реакции;
2) 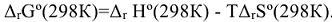 .
.
Изменение стандартной энергии Гиббса служит для оценки принципиальной возможности самопроизвольного протекания процесса. Если 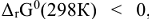 процесс принципиально возможен, если
процесс принципиально возможен, если 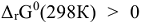 , процесс самопроизвольно протекать нс может.
, процесс самопроизвольно протекать нс может.
Скорость химических реакций. Химическое равновесие
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции):
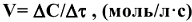
где V- скорость химической реакции; 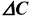 — изменение концентрации вещества;
— изменение концентрации вещества; 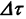 -промежуток времени.
-промежуток времени.
Так как изменения концентраций участвующих в реакции веществ находятся в стехиометрической зависимости друг от друга, то для выражения скорости химической реакции может быть взято изменение концентрации любого из участвующих в реакции веществ.
Скорость реакции зависит от природы реагирующих веществ, температуры, концентрации веществ, от присутствия в системе катализатора и дисперсности (для гетерогенных реакций).
Зависимость скорости реакции от концентрации реагирующих веществ для простейшей одностадийной реакции выражается законом действия масс: скорость химической реакции (V) при постоянных внешних условиях (Р,Т) прямо пропорциональна произведению концентраций реагирующих веществ в степенях, которые соответствуют коэффициентам в уравнении реакции. Для реакций, протекающих по схеме 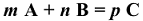
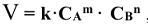
где 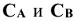 — концентрации реагирующих веществ, моль/л; m и n — стехиометрические коэффициенты в уравнении реакции; k — константа скорости реакции.
— концентрации реагирующих веществ, моль/л; m и n — стехиометрические коэффициенты в уравнении реакции; k — константа скорости реакции.
Так как скорость химической реакции зависит от температуры, то k — величина, постоянная только при данной температуре и нс зависит от концентрации реагирующих веществ.
Порядок простых реакций определяется суммой показателей степеней при концентрациях реагирующих веществ в уравнении скорости реакции.
Для реакции первого порядка 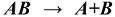 константа скорости определяется по уравнению:
константа скорости определяется по уравнению:
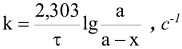
где 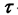 — продолжительность реакции,с; а — исходная концентрация вещества, моль/л;
— продолжительность реакции,с; а — исходная концентрация вещества, моль/л; 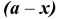 — концентрация вещества (моль/л) по истечении времени
— концентрация вещества (моль/л) по истечении времени 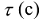 .
.
Закон действия масс относится только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют также твердые вещества, концентрация которых постоянна (гетерогенные реакции), то скорость реакции изменяется только в зависимости от концентрации газообразных или растворенных веществ:
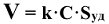
где С — концентрация газообразного или жидкого вещества, моль/л; 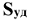 — суммарная площадь поверхности, м
— суммарная площадь поверхности, м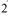 /г.
/г.
Приближенная зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 — 4 раза:
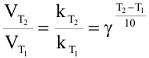
где 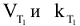 — скорость и константа скорости реакции при температуре
— скорость и константа скорости реакции при температуре 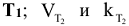 — скорость и константа скорости реакции при температуре
— скорость и константа скорости реакции при температуре 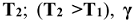 — температурный коэффициент скорости реакции
— температурный коэффициент скорости реакции 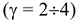 .
.
Зависимость константы скорости реакции от энергии активации 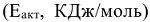 выражается уравнением Аррениуса:
выражается уравнением Аррениуса:
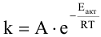
где А — предэкспонснциальный множитель; е — основание натурального логарифма (2,718…);
R — универсальная газовая постоянная 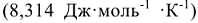 ; Т — температура, К;
; Т — температура, К; 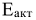 -энергия активации, т.е. минимальная избыточная энергия (по сравнению со значением средней энергии реагирующих молекул), которой должны обладать молекулы, чтобы реакция стала возможной.
-энергия активации, т.е. минимальная избыточная энергия (по сравнению со значением средней энергии реагирующих молекул), которой должны обладать молекулы, чтобы реакция стала возможной.
В общем случае, если температура реакции изменилась от 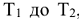 уравнение (5.6) преобразуется к виду:
уравнение (5.6) преобразуется к виду:
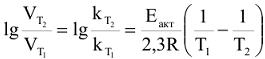
Скорость химических реакций возрастает в присутствии катализатора. Зависимость скорости реакции от наличия катализатора выражается следующим уравнением:
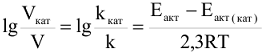
где 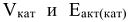 — скорость и энергия активации химической реакции в присутствии катализатора; V и
— скорость и энергия активации химической реакции в присутствии катализатора; V и 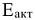 — скорость и энергия активации реакции химической реакции без катализатора.
— скорость и энергия активации реакции химической реакции без катализатора.
Реакции, протекающие одновременно в двух взаимно противоположных направлениях, называют обратимыми.
Реакцию, протекающую слева направо, называют прямой, а справа налево — обратной.
В начале процесса, когда концентрация исходных веществ велика, а конечных продуктов мала, скорость прямой реакции больше обратной. По мере уменьшения концентраций исходных веществ и увеличения концентраций продуктов реакции, скорость прямой реакции уменьшается, а скорость обратной реакции возрастает. Через некоторое время эти скорости становятся равными и наступает состояние химического равновесия. Это состояние характеризуется константой химического равновесия.
Для реакции  константа равновесия выразится уравнением
константа равновесия выразится уравнением
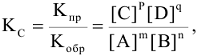
В этом уравнении [А], [С], [D], [В] — равновесные концентрации реагирующих веществ (моль/л), n, m, р, q — стехиометрические коэффициенты в уравнении реакции, 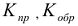 — константы скоростей прямой и обратной реакций.
— константы скоростей прямой и обратной реакций.
Константа равновесия может быть выражена также через парциальные давления. Для реакции 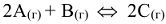
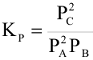
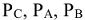 — равновесные парциальные давления реагирующих веществ.
— равновесные парциальные давления реагирующих веществ.
В выражение константы равновесия 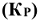 для реакций, протекающих в гетерогенных системах включаются только газовые моль.
для реакций, протекающих в гетерогенных системах включаются только газовые моль.
Например:
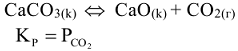
Константа равновесия химической реакции связана со стандартным изменением энергии Гиббса уравнением:
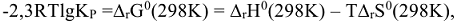
Вычислив 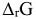 при любой температуре, можно рассчитать при этих условиях значение
при любой температуре, можно рассчитать при этих условиях значение 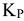 . Следует отметить, что
. Следует отметить, что 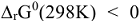 только в случае, когда
только в случае, когда 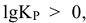 т.е.
т.е. 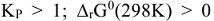 , когда
, когда 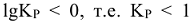 . В целом константа равновесия определяет глубину протекания процесса к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения исходных веществ в конечные. Случай, когда
. В целом константа равновесия определяет глубину протекания процесса к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения исходных веществ в конечные. Случай, когда 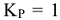 , соответствует минимуму энергии Гиббса, т.е.
, соответствует минимуму энергии Гиббса, т.е. 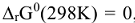 тогда
тогда 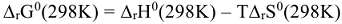 , отсюда можно определить температуру, при которой
, отсюда можно определить температуру, при которой 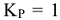 .
.
Система будет находиться в состоянии равновесия до тех пор, пока внешние условия (температура, давление, объем и концентрация), остаются неизменными. При изменении условий, система переходит в новое равновесное состояние. Направление смещения химического равновесия определяется принципом Ле Шательс: «Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, путем изменения Р, V, Т, С, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие»,
а) Влияние температуры.
Направление сдвига равновесия зависит от знака изменения энтальпии химической реакции.
Повышение температуры ведет к сдвигу равновесия в ту сторону, которая идет с поглощением теплоты (т.с. эндотермической реакции), а понижение температуры смещает равновесия в сторону той реакции, которая протекает с выделением теплоты (экзотермической реакции).
Для реакции 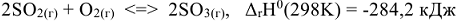 к аналогичному выводу приходим из выражения зависимости константы равновесия и энергии Гиббса
к аналогичному выводу приходим из выражения зависимости константы равновесия и энергии Гиббса
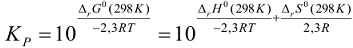
Так как 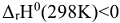 , то значение
, то значение 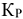 будет равно 10 в дробной положительной степени.
будет равно 10 в дробной положительной степени.
Дробное слагаемое  от температуры не зависит. Тогда при понижении температуры и отрицательном значении
от температуры не зависит. Тогда при понижении температуры и отрицательном значении 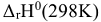 дробное слагаемое
дробное слагаемое 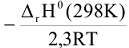 будет иметь знак (+) и будет возрастать т.е. суммарное значение показателя степени и значение
будет иметь знак (+) и будет возрастать т.е. суммарное значение показателя степени и значение 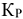 будут возрастать. А это означает, что количество продуктов реакции должны возрасти, что возможно при смещении равновесия вправо
будут возрастать. А это означает, что количество продуктов реакции должны возрасти, что возможно при смещении равновесия вправо 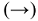 .
.
б) Влияние концентрации.
Константа равновесия 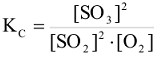 не зависит от концентрации реагирующих веществ.
не зависит от концентрации реагирующих веществ.
Поэтому при повышении концентрации 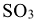 при неизменном значении
при неизменном значении 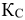 должны возрасти концентрации исходных веществ, а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево
должны возрасти концентрации исходных веществ, а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево 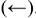 .
.
в) Влияние давления.
В соответствии с принципом Ле Шателье увеличение давления смещает равновесие в сторону той (прямой или обратной) реакции, которая сопровождается уменьшением суммарного числа моль газообразных веществ (уменьшением давления).
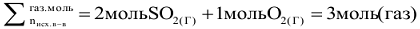
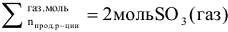
Следовательно, при повышении давления равновесие системы смещается вправо 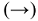 .
.
При понижении давления равновесие смещается соответственно влево.
Физико-химические свойства растворов
Неэлектролиты — вещества, водные растворы и расплавы которых нс проводят электрический ток, так как их молекулы не диссоциируют на ионы: глюкоза 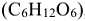 , сахароза
, сахароза 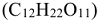 . Некоторые свойства разбавленных растворов неэлектролитов зависят только от числа частиц в растворе.
. Некоторые свойства разбавленных растворов неэлектролитов зависят только от числа частиц в растворе.
Понижение давления насыщенного пара растворителя 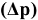 над раствором нелетучего неэлектролита пропорционально молярной доле растворенного неэлектролита.
над раствором нелетучего неэлектролита пропорционально молярной доле растворенного неэлектролита.
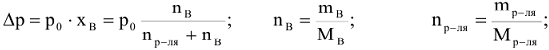
где 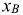 — молярная доля растворенного вещества;
— молярная доля растворенного вещества;
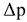 — понижение давления насыщенного пара растворителя над раствором, кПа;
— понижение давления насыщенного пара растворителя над раствором, кПа;
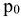 — давление насыщенного пара над чистым растворителем, кПа;
— давление насыщенного пара над чистым растворителем, кПа;
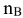 — количество растворенного неэлектролита, моль;
— количество растворенного неэлектролита, моль;
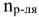 — количество растворителя, моль;
— количество растворителя, моль;
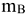 — масса растворенного неэлектролита, г;
— масса растворенного неэлектролита, г;
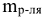 — масса растворителя, г;
— масса растворителя, г;
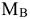 — молярная масса неэлектролита, г/моль;
— молярная масса неэлектролита, г/моль;
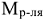 — молярная масса растворителя, г/моль.
— молярная масса растворителя, г/моль.
Давление насыщенного пара растворителя (р) над раствором пропорционально молярной доле растворителя.
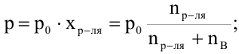
где 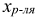 — молярная доля растворителя.
— молярная доля растворителя.
Понижение температуры замерзания и повышение температуры кипения раствора неэлектролита пропорционально моляльности растворенного вещества 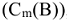 , моль/кг.
, моль/кг.
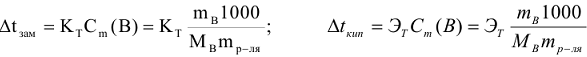
где 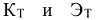 — соответственно криоскопическая и эбуллиоскопическая константы растворителя или понижение температуры замерзания и повышение температуры кипения одномоляльного раствора неэлектролита.
— соответственно криоскопическая и эбуллиоскопическая константы растворителя или понижение температуры замерзания и повышение температуры кипения одномоляльного раствора неэлектролита.
Для воды: 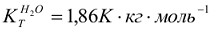 ,
, 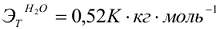
Осмотическое давление (л, кПа) равно давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
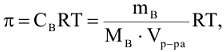
где 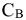 — молярная концентрация вещества, моль/л;
— молярная концентрация вещества, моль/л;
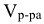 — объем раствора, л;
— объем раствора, л;
Т — температура, К;
R — универсальная газовая постоянная (8,314 л кПа 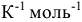 )
)
Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток (соли, основания, кислоты). Электролиты в расплавах или водных растворах диссоциируют на ионы. Поэтому общее число частиц растворенного вещества в растворе увеличивается по сравнению с раствором неэлектролита такой же концентрации в i раз (i — изотонический коэффициент).
В водных растворах, вес ионы электролита окружены молекулами воды (гидратированы). В концентрированных растворах сильных электролитов гидратированные ионы взаимодействуют между собой. Это взаимодействие определяется величиной кажущейся степени его диссоциации 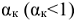 . Кажущаяся степень электролитической диссоциации для сильных электролитов связана с изотоническим коэффициентом уравнением:
. Кажущаяся степень электролитической диссоциации для сильных электролитов связана с изотоническим коэффициентом уравнением: 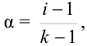
где к — суммарное число ионов, на которые диссоциирует одна молекула электролита. Для 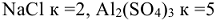 и т.д. При применении вышеуказанных законов к растворам сильных электролитов все расчеты должны проводиться с учетом изотонического коэффициента.
и т.д. При применении вышеуказанных законов к растворам сильных электролитов все расчеты должны проводиться с учетом изотонического коэффициента.
Для электролитов:
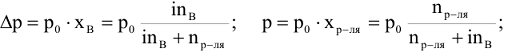
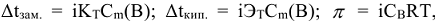 где все обозначения аналогичны обозначениям для неэлектролитов.
где все обозначения аналогичны обозначениям для неэлектролитов.
Растворы сильных и слабых электролитов. Диссоциация электролитов
При растворении электролитов в полярных растворителях они в различной степени распадаются на катионы и анионы. Этот процесс называется электролитической диссоциацией.
Электролиты, диссоциирующие нс полностью называются слабыми. К ним относятся вода, гидроксид аммония, труднорастворимые гидроксиды, минеральные кислоты (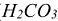 ,
, 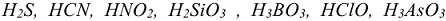 ) и почти все органические кислоты. В растворах слабых электролитов устанавливается следующее равновесие:
) и почти все органические кислоты. В растворах слабых электролитов устанавливается следующее равновесие:
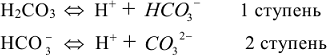
тогда: первое равновесие (диссоциация по первой ступени) характеризуется первой константой диссоциации:
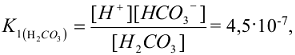
а второе — ( диссоциация по второй ступени ) — второй константой диссоциации:
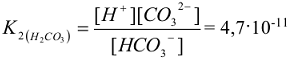
Суммарной реакции диссоциации: 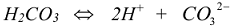 отвечает суммарная
отвечает суммарная
константа равновесия:
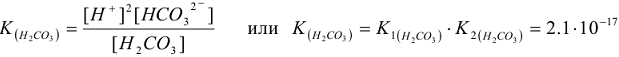
Константа диссоциации по первой ступени всегда больше константы диссоциации по второй ступени: 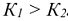 .
.
Для слабых электролитов:
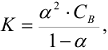
где: 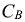 — молярная концентрация электролита, моль/л
— молярная концентрация электролита, моль/л
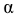 — степень диссоциации электролита — отношение числа его молекул, распавшихся на ионы к общему числу молекул электролита в растворе.
— степень диссоциации электролита — отношение числа его молекул, распавшихся на ионы к общему числу молекул электролита в растворе.
Для электролитов, у которых 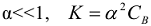 , тогда
, тогда 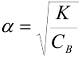
Электролиты, практически полностью диссоциирующие в полярных растворителях, называются сильными электролитами.
В растворах сильных электролитов концентрация ионов велика, поэтому силы межионного взаимодействия заметно проявляются уже при незначительной концентрации электролита. В связи с этим значение степени диссоциации сильных электролитов называется кажущейся степенью диссоциации 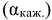
Для оценки состояния ионов в растворах сильных электролитов пользуются активностью (а). Это эффективная, условная концентрация иона, соответственно которой он действует в химических реакциях.
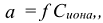
где 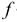 — коэффициент активности
— коэффициент активности
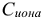 — молярная концентрация иона, моль/л.
— молярная концентрация иона, моль/л.
Коэффициент активности ионов зависит от состава и концентрации раствора, от заряда и природы иона. В разбавленных растворах 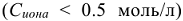 коэффициент активности зависит только от заряда иона (z) и ионной силы (I) раствора:
коэффициент активности зависит только от заряда иона (z) и ионной силы (I) раствора:
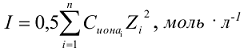
Значения коэффициентов активности ионов в зависимости от их заряда и ионной силы раствора приведены в таблице П4. Приближенно коэффициент активности можно определить по следующим формулам:
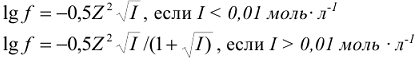
Произведение растворимости
Равновесие в насыщенном растворе сильного малорастворимого электролита устанавливается между твердой солью (осадок) и перешедшими в раствор ионами:
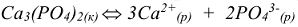
тогда
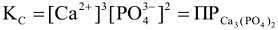
Произведение концентраций ионов в степенях их стехиометрических коэффициентов малорастворимого электролита, содержащихся в его насыщенном растворе ( произведение растворимости ), есть величина постоянная при данной температуре (табл.П5)
Ионное произведение воды. Водородный показатель
Вода, являясь слабым электролитом, в незначительной степени диссоциирует:
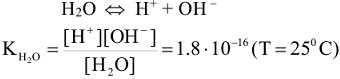
принимая концентрацию недиссоциированых молекул воды постоянной, (55,55 моль/л) получаем 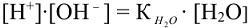 и обозначая
и обозначая 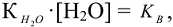 получим
получим 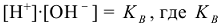 — ионное произведение воды.
— ионное произведение воды.
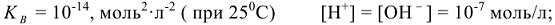
Кислотность или щелочность раствора можно выразить с помощью водородного показателя.
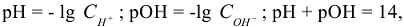 , тогда
, тогда
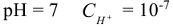 моль/л — нейтральный раствор
моль/л — нейтральный раствор
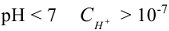 моль/л — кислый раствор
моль/л — кислый раствор
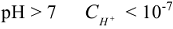 моль/л — щелочной раствор.
моль/л — щелочной раствор.
Ионно-молекулярные уравнения. Гидролиз солей
При растворении в воде или других полярных растворителях, молекулы электролитов подвергаются электролитической диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы (катионы и анионы). Электролиты, диссоциирующие в растворе полностью, называются сильными, а нс полностью — слабыми (табл 8.1).
Таблица 8.1

Диссоциация слабых электролитов протекает в основном по I ступени.
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, осадками и газами участвуют, находящиеся в растворе ионы. Поэтому механизм протекания реакций в растворе наиболее полно выражается при замене молекулярных уравнений ионно-молекулярными. В таких уравнениях слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а сильные электролиты в виде ионов (табл. П2).
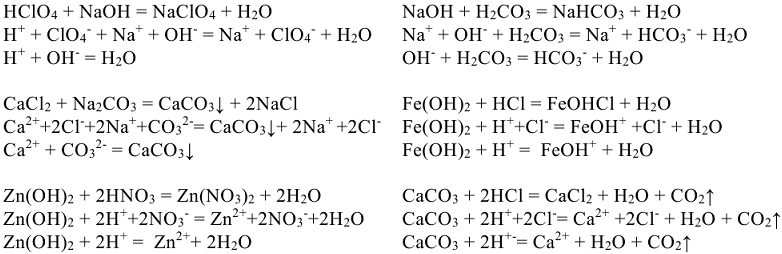
Рассмотренные примеры показывают, что обменные реакции в растворах электролитов протекают в направлении связывания ионов, приводящего к образованию осадков, газов или слабых электролитов.
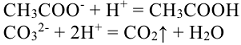
В тех случаях, когда осадки или слабые электролиты имеются как среди исходных веществ, так и среди продуктов реакции, равновесие смещается в сторону образования менее диссоциирующих веществ.
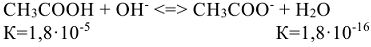
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания — обратимы, т.с. могут протекать как в прямом так и обратном направлениях. Это значит, что при растворении в воде соли, в состав которой входит анион слабой кислоты или катион слабого основания, протекает процесс гидролиза — обменное взаимодействие ионов соли с водой, сопровождающееся изменением pH среды.
Правило написания молекулярного и ионно-молекулярного уравнений гидролиза соли, например:
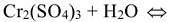
1. Под формулой соли написать формулы основания и кислоты, которыми образована соль:
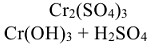
2. Определить силу основания и кислоты:
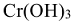 — слабое основание,
— слабое основание, 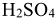 — сильная кислота.
— сильная кислота.
3. Подчеркнуть общий ион в формуле слабого электролита и в формуле соли:
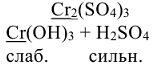
4. Написать сокращенное ионно-молекулярное уравнение гидролиза с участием одного подчеркнутого иона и одной молекулы воды:
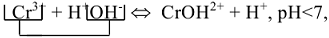 , среда кислая
, среда кислая
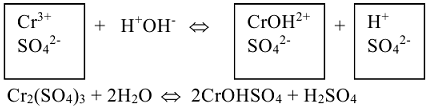
5. По полученному сокращенному ионно-молекулярному уравнению написать полное молекулярное уравнение, используются ионы соли, не участвующие в гидролизе. Объединить ионы по правилу электронейтральности молекулы и расставить коэффициенты:
Количественно протекание гидролиза определяется степенью гидролиза (h), представляющую собой отношение числа гидролизованных молекул 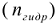 к общему числу молекул соли, введенных в раствор
к общему числу молекул соли, введенных в раствор 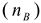 .
.
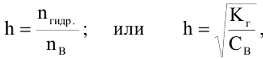
где 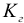 — константа гидролиза;
— константа гидролиза; 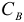 — молярная концентрация соли.
— молярная концентрация соли.
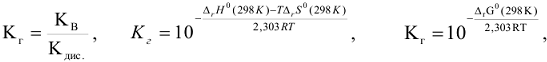
где 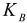 — ионное произведение воды
— ионное произведение воды 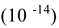
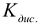 — константа диссоциации слабого электролита, участвующего в образовании соли по последней ступени диссоциации.
— константа диссоциации слабого электролита, участвующего в образовании соли по последней ступени диссоциации.
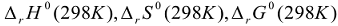 — соответственно изменения энтальпии, энтропии и энергии Гиббса реакции гидролиза.
— соответственно изменения энтальпии, энтропии и энергии Гиббса реакции гидролиза.
Константу, степень и pH гидролиза рассчитывают по формулам (табл. 8.2).
Таблица 8.2
Расчет константы, степени и pH гидролиза
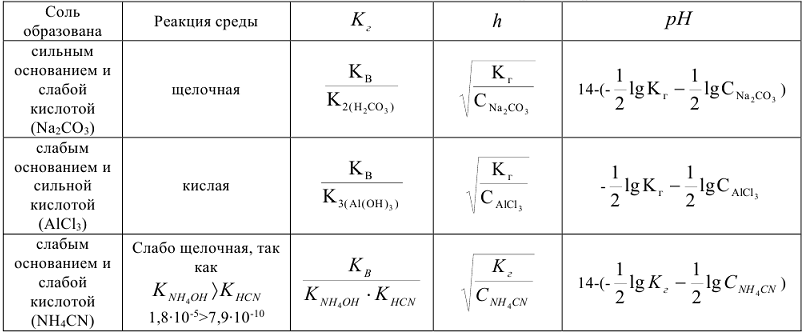
Гидролиз протекает в основном по первой ступени, однако степень гидролиза возрастает с разбавлением раствора, при повышении температуры, а также при связывании продуктов гидролиза в слабодиссоциирующис соединения.
Возможно эта страница вам будет полезна:
| Решение задач по неорганической химии |
Окислительно — восстановительные реакции
Реакции, сопровождающиеся изменением степеней окисления элементов в молекулах реагирующих веществ, называются окислительно-восстановительными.
Степень окисления — это условный заряд атома в молекуле, вычисленный из предположения, что молекула состоит из ионов и в целом электронейтральна.
Для установления степени окисления элемента, следует руководствоваться следующими правилами:
1. Степень окисления элементов простых веществ равна нулю 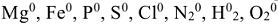 .
.
2. В водородосодержащих соединениях степень окисления водорода всегда (+1), за исключением гидридов металлов, в которых степень окисления водорода равна (-1). 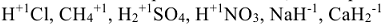
3. В кислородсодержащих соединениях, степень окисления кислорода всегда (-2), за исключением пероксидов, в которых степень окисления кислорода (-1) и  .
.
4. Степень окисления одного из элементов в молекуле можно определить по степени окисления других элементов, поскольку молекула в целом электронейтральна.
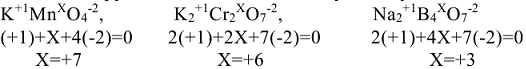
5. Сумма степеней окисления всех элементов, входящих в состав иона, равна заряду иона.
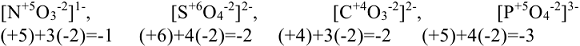
6. Для элементов положительная степень окисления не может превышать величины, равной номеру группы Периодической системы, из которой взят данный элемент 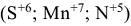 . Окислительно-восстановительная реакция, состоит из полуреакций окисления и восстановления.
. Окислительно-восстановительная реакция, состоит из полуреакций окисления и восстановления.
Вещество, которое принимает электроны, называется окислителем, а вещество, которое отдаст электроны — восстановителем.
Процесс, связанный с потерей электронов, называется окислением, а процесс связанный с присоединением электронов — восстановлением.
Так, в реакции
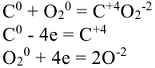
окислитель —  , восстановитель — С
, восстановитель — С
Число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, поэтому стехиометрические коэффициенты окислительно-восстановительных реакций определяют, используя метод электронного баланса или метод электронно-ионного баланса:
Порядок составления уравнений окислительно-восстановительных реакций (метод электронного баланса):
- Написать формулы исходных веществ и продуктов реакций.
- Определить элементы, которые меняют свою степень окисления.
- Составить две полурсакции для окислителя и восстановителя и определить число принятых и отданных электронов.
- Найти наименьшее общее кратное между числом принятых и отданных электронов и определить дополнительные множители к обеим полурсакциям.
- Умножить дополнительные множители на соответствующие полурсакции и сложить их левые и правые части. Полученные коэффициенты перенести в молекулярное уравнение
- Если окислитель или восстановитель расходуется на получение других продуктов реакции, в которых степень их окисления не меняется, то необходимо уточнить коэффициенты.
- Уравнять число атомов водорода и кислорода.
Пример 7:
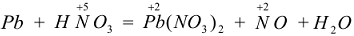
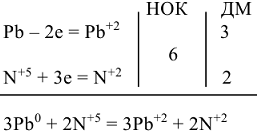
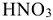 расходуется на получение 2 моль NO и 3 моль
расходуется на получение 2 моль NO и 3 моль 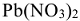 , поэтому в левую часть реакции добавляем
, поэтому в левую часть реакции добавляем 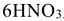
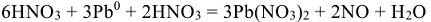
В итоге 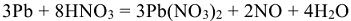
Порядок составления уравнений окислительно-восстановительных реакций (метод электронно-ионного баланса):
- Составить ионную схему реакции, руководствуясь общими правилами составления ионных уравнений: сильные электролиты записать в виде ионов, а неэлектролиты, слабые электролиты, осадки и газы — в виде молекул; в ионную схему включать только те частицы, которые изменяют свое состояние, т.е. выполняют функцию окислителя или восстановителя.
- Составить электронно-ионные уравнения полуреакций, руководствуясь следующим: а) если продукт реакции содержит больше кислорода, чем исходное вещество, то расходуется либо вода — в нейтральных и кислых растворах, либо ОН’ — в щелочных растворах; б) если продукт реакции содержит меньше кислорода, чем исходное вещество, то в кислой среде образуется вода, а в нейтральной и щелочной — ионы ОН’. Определить число принятых и отданных в каждой полуреакции электронов.
- Найти наименьшее общее кратное между числом принятых и отданных электронов и определить дополнительные множители к каждой полуреакции.
- Сложить электронно-ионные уравнения процессов восстановления и окисления, предварительно умноженные на найденные дополнительные множители.
- По полученному ионному уравнению составить молекулярное уравнение.
Пример 8:
Расставить коэффициенты в уравнении
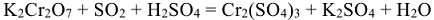
1. Сокращенная ионно-молекулярная схема реакции:
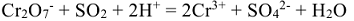
2. а) Составить электронно-ионное уравнение для процесса восстановления. Ион 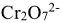 превращается в ион
превращается в ион 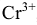 , т.е. получается продукт реакции, не содержащий кислорода. Так как реакция протекает в кислой среде, то вторым продуктом реакции будет вода. На каждый атом кислорода расходуется по два иона Н+:
, т.е. получается продукт реакции, не содержащий кислорода. Так как реакция протекает в кислой среде, то вторым продуктом реакции будет вода. На каждый атом кислорода расходуется по два иона Н+:
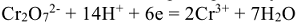
б) Составить электронно-ионное уравнение для процесса окисления. Получающийся ион 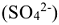 содержит больше кислорода, чем исходное вещество
содержит больше кислорода, чем исходное вещество 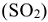 . Следовательно, в процессе реакции окисления кислород потребляется. Так как реакция протекает в кислой
. Следовательно, в процессе реакции окисления кислород потребляется. Так как реакция протекает в кислой
среде, в окислительно-восстановительном процессе принимает участие вода:
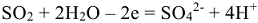
3. Определить наименьшее общее кратное и дополнительные множители:
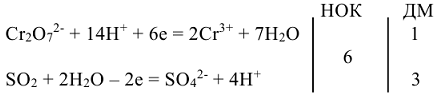
4. Ионное уравнение реакции:
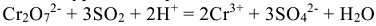
5. Молекулярное уравнение реакции:
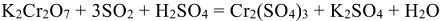
По закону эквивалентов: 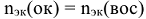
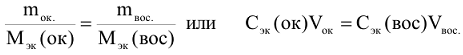
Молярная масса эквивалентов окислителя равна молярной массе окислителя, деленной на число электронов, принятых одной молекулой окислителя.
Молярная масса эквивалента восстановителя равна молярной массе восстановителя, деленной на число электронов, отданных одной молекулой восстановителя.
Поскольку одно и тоже вещество в разных реакциях может отдавать или принимать разное количество электронов, то молярная масса его эквивалентов может иметь разные значения. Так, например, 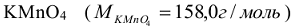 в зависимости от среды восстанавливается по разному. В кислой среде
в зависимости от среды восстанавливается по разному. В кислой среде 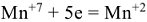 в нейтральной
в нейтральной 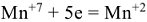 и в щелочной
и в щелочной 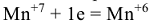 . Поэтому молярные массы эквивалентов для
. Поэтому молярные массы эквивалентов для 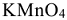 будут равны его молярной массе, деленной соответственно на 5;3 и 1 т.е. 31,6 г/моль, 52,7 г/моль и 158,0 г/моль.
будут равны его молярной массе, деленной соответственно на 5;3 и 1 т.е. 31,6 г/моль, 52,7 г/моль и 158,0 г/моль.
Самопроизвольно протекающие окислительно-восстановительные реакции сопровождаются уменьшением энергии Гиббса, которую можно рассчитать по уравнению.
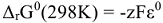
где z — число электронов принимающих участие в реакции (наименьшее общее кратное).
F — постоянная Фарадея — 96500 кл/моль.
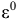 — стандартное напряжение окислительно-восстановительной реакции, В
— стандартное напряжение окислительно-восстановительной реакции, В
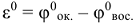
где 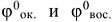 — стандартные электродные потенциалы окислителя и восстановителя (табл.П7)
— стандартные электродные потенциалы окислителя и восстановителя (табл.П7)
Так как z и F величины положительные, то направление протекания окислительно-восстановительной реакции определяется знаком при 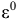 , если
, если 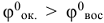 , то
, то 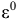 величина положительная, a
величина положительная, a 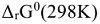 — величина отрицательная, поэтому самопроизвольное протекание прямой реакции возможно. Если же
— величина отрицательная, поэтому самопроизвольное протекание прямой реакции возможно. Если же 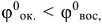 , то возможно самопроизвольное протекание обратной реакции. Глубина протекания окислительно-восстановительной реакции определяется константой равновесия.
, то возможно самопроизвольное протекание обратной реакции. Глубина протекания окислительно-восстановительной реакции определяется константой равновесия.
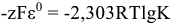
После подстановки значений 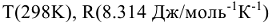 и F(96500 Кл/моль) получим
и F(96500 Кл/моль) получим
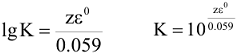
Возможно эта страница вам будет полезна:
| Химия экзаменационные билеты |
Гальванический элемент
Гальваническими элементами (ГЭ) называются устройства, в которых энергия окислительно-восстановительных реакций превращается в электрическую энергию. Гальванический элемент состоит из двух электродов (окислительно-восстановительных систем), соединенных между собой металлическим проводником. Электроды погружены в растворы электролитов; последние сообщаются друг с другом чаще всего через пористую перегородку. На каждом электроде происходит полуреакция (электродный процесс): на аноде — процесс окисления; на катоде — процесс восстановления. Гальванические элементы изображаются в виде схем.
Так, схема ГЭ, в основе работы которой лежит реакция
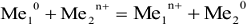
изображается следующим образом:
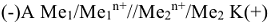
Причем, анодом является более активный металл, а катодом менее активный металл 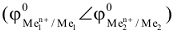 процесс на аноде:
процесс на аноде: 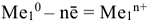 процесс на катоде:
процесс на катоде: 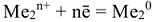
Например, для реакции, протекающей в ГЭ:
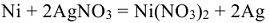
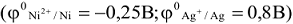
схема ГЭ имеет вид:
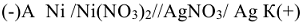
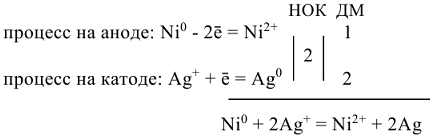
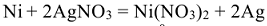 — суммарная токообразующая реакция.
— суммарная токообразующая реакция.
Напряжение ГЭ (е°) при стандартных условиях рассчитывается по формуле:
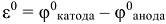
где 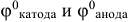 — значения стандартных электродных потенциалов катода и анода (табл. П7).
— значения стандартных электродных потенциалов катода и анода (табл. П7).
При условиях, отличающихся от стандартных, численное значение электродного потенциала определяется по уравнению Нернста:
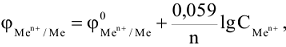
где 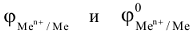 соответственно электродный и стандартный электродный потенциалы металла, В.
соответственно электродный и стандартный электродный потенциалы металла, В.
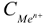 — молярная концентрация катиона металла в растворе, моль/л.
— молярная концентрация катиона металла в растворе, моль/л.
Значение электродного потенциала водорода рассчитывается по формуле:
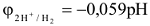
Условием самопроизвольного протекания химического процесса при стандартных условиях является, как известно, 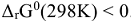 .
.
Взаимосвязь между изменением энергии Гиббса и напряжением ГЭ выражается формулой:
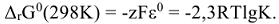
Константа равновесия соответствующей окислительно-восстановительной реакции
вычисляется по формуле: 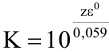
Возможно эта страница вам будет полезна:
| Помощь по химии |
Коррозия металлов
Коррозией называется процесс самопроизвольного разрушения металлов под действием агрессивных сред. По механизму взаимодействия металлов с агрессивными средами коррозию можно разделить на два типа: химическую и электрохимическую.
Химическая коррозия представляет собой разрушение металлов вследствие непосредственного взаимодействия их с сухими агрессивными газами 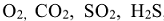 ,
, 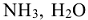 (газовая коррозия), или с агрессивными компонентами в жидких неэлектролитах, например в нефтепродуктах (коррозия в неэлектролитах).
(газовая коррозия), или с агрессивными компонентами в жидких неэлектролитах, например в нефтепродуктах (коррозия в неэлектролитах).
При контакте металла с водой, растворами электролитов, влажными газами, наблюдается электрохимическая коррозия — наиболее распространенный вид коррозии металлов.
Процессы, протекающие при электрохимической коррозии: анодные: 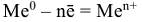
катодные: 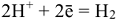 — водородная деполяризация;
— водородная деполяризация;
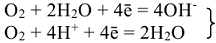 кислородная деполяризация.
кислородная деполяризация.
Например, схема коррозионного ГЭ, составленного из железа 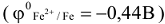 , частично покрытого оловом
, частично покрытого оловом 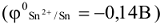 в атмосферных условиях, имеет вид:
в атмосферных условиях, имеет вид:
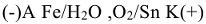
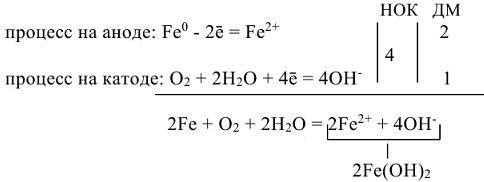
Вторичный процесс: 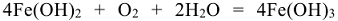 суммарная реакция процесса коррозии.
суммарная реакция процесса коррозии.
Количественно скорость коррозии характеризуется следующими показателями коррозии:
— весовой показатель 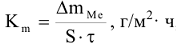
где 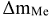 — масса металла, превратившегося в продукт коррозии, г;
— масса металла, превратившегося в продукт коррозии, г;
S — площадь поверхности металла, м2;
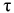 — продолжительность коррозии, ч.
— продолжительность коррозии, ч.
— объемный показатель 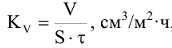
где V — объем газа, выделяющегося или поглощающегося при коррозии, см3;
— глубинный показатель 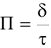 , мм/год,
, мм/год,
где 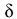 — глубина проникновения коррозии в металл, мм;
— глубина проникновения коррозии в металл, мм;
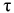 — продолжительность коррозии, год.
— продолжительность коррозии, год.
Весовой и глубинный показатели коррозии связаны уравнением:
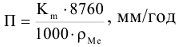
где 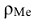 — плотность металла, подвергающегося коррозии, г/см3;
— плотность металла, подвергающегося коррозии, г/см3;
8760 — число часов в году.
Объемный и весовой показатели связаны уравнением:
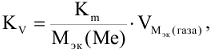
где 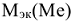 — молярная масса эквивалента корродируемого металла, г/моль;
— молярная масса эквивалента корродируемого металла, г/моль;
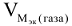 — молярный объем эквивалента газа, выделяющегося или поглощающегося при коррозии металла, см3/моль.
— молярный объем эквивалента газа, выделяющегося или поглощающегося при коррозии металла, см3/моль.
Электролиз
Электролиз — совокупность окислительно-восстановительных процессов, протекающих при прохождении постоянного электрического тока через расплавы или растворы электролитов.
При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза (электролизер) состоит из двух электродов, погруженных в расплав или раствор электролита. Электрод, на котором идет реакция восстановления (катод), подключен к отрицательному полюсу внешнего источника постоянного тока. Электрод на котором протекает реакция окисления (анод), подключен к положительному полюсу постоянного источника тока.
При прохождении тока через расплав электролита катионы электролита под действием электрического поля движутся к катоду и восстанавливаются, анионы перемещаются к аноду и окисляются.
В водных растворах, кроме ионов самого электролита, находятся также молекулы воды, способные восстанавливаться на катоде и окисляться на аноде, а также ионы 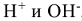 , относительная концентрация которых определяется средой. В этом случае при электролизе возможны конкурирующие реакции. Критерием, определяющим преимущество того или иного электрохимического процесса, служит величина стандартного электродного потенциала соответствующих равновесных систем. Чем выше потенциал, тем легче восстанавливается окисленная форма системы, а чем он ниже, тем легче окисляется восстановленная форма. Таким образом, характер катодного процесса (таблица 11.1) при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. При рассмотрении анодных процессов (таблица 11.2) следует иметь в виду, что материал анода в процессе электролиза также может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным, растворимым анодом. Если анод инертный
, относительная концентрация которых определяется средой. В этом случае при электролизе возможны конкурирующие реакции. Критерием, определяющим преимущество того или иного электрохимического процесса, служит величина стандартного электродного потенциала соответствующих равновесных систем. Чем выше потенциал, тем легче восстанавливается окисленная форма системы, а чем он ниже, тем легче окисляется восстановленная форма. Таким образом, характер катодного процесса (таблица 11.1) при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. При рассмотрении анодных процессов (таблица 11.2) следует иметь в виду, что материал анода в процессе электролиза также может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным, растворимым анодом. Если анод инертный 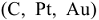 на аноде в первую очередь окисляются анионы бескислородных кислот —
на аноде в первую очередь окисляются анионы бескислородных кислот — 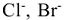 и др., затем гидроксид ионы
и др., затем гидроксид ионы 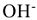 и в последнюю очередь молекулы воды. Анионы кислородосодержащих кислот
и в последнюю очередь молекулы воды. Анионы кислородосодержащих кислот 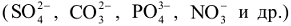 в водных растворах окисляться на аноде нс могут, т.к. имеют более высокий окислительно-восстановительный потенциал, чем потенциал выделения кислорода из воды.
в водных растворах окисляться на аноде нс могут, т.к. имеют более высокий окислительно-восстановительный потенциал, чем потенциал выделения кислорода из воды.
Количественная характеристика электролиза выражается двумя законами Фарадея:
- При электролизе различных химических соединений равные количества электричества выделяют на электродах массы вещества, пропорциональные молярным массам их эквивалентов.
- Масса вещества выделяющегося на электродах или разлагающегося при электролизе прямо пропорциональна количеству прошедшего через электролит электричества:
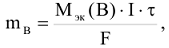
где 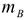 — масса вещества, выделяющегося на электродах, г;
— масса вещества, выделяющегося на электродах, г;
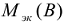 — молярная масса эквивалента вещества, г/моль;
— молярная масса эквивалента вещества, г/моль;
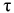 — время электролиза, сек (час);
— время электролиза, сек (час);
F — постоянная Фарадея, равная 96500 Кл/моль, если 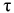 — с, и 26,8 Ач/моль, если
— с, и 26,8 Ач/моль, если 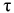 — час. I — сила тока, А.
— час. I — сила тока, А.
Отношение массы вещества, фактически выделившегося на электродах 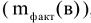 , к теоретически возможному
, к теоретически возможному 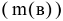 называется выходом по току
называется выходом по току 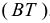 .
.
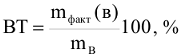
Таблица 11.1
Схемы протекания катодных процессов
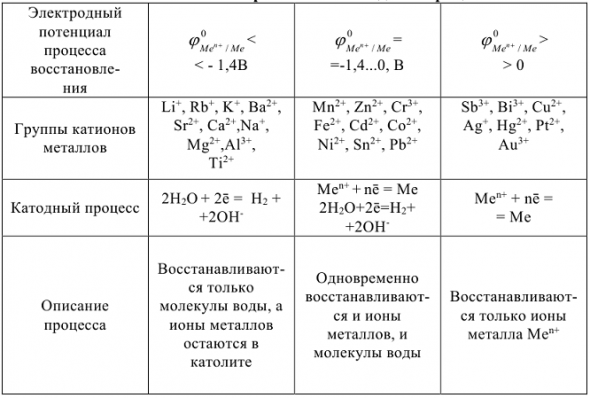
Таблица 11.2
Схемы протекания анодных процессов

Химические свойства металлов
Более 80% химических элементов являются металлами. Основной источник получения металлов — восстановление их из руд: 
Восстановление проводят химическими или электрохимическими способами. Химическое восстановление заключается во взаимодействии соединений металлов с углем, водородом или мсталлами-восстановитслями. Например, по реакциям :
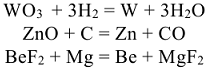
Электролизом из растворов осаждают медь, никель, серебро, хром, кадмий и др. металлы. Электролизом из расплавов осаждаются сильные восстановители, такие как щелочные и щелочно-земельные металлы, а так же магний и алюминий.
Например, при электролизе расплава хлорида натрия на электродах протекают следующие процессы: на аноде 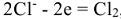 , на катоде
, на катоде 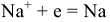
Металлы в соединениях проявляют только положительную степень окисления и в химических реакциях выступают в роли восстановителей.
Так, большинство металлов легко взаимодействуют с галогенами с образованием галидов:
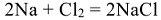
С кислородом металлы взаимодействуют менее энергично, что объясняется большей энергией диссоциации его молекул:
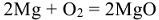
При нагревании все металлы легко взаимодействуют с серой, фосфором, бором и др. неметаллами:
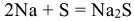
При обычных условиях с водой взаимодействуют щелочные и щелочноземельные металлы:
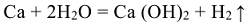
Остальные металлы способны взаимодействовать с парами воды при высокой температуре:
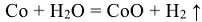
С водными растворами щелочей при обычных условиях способны взаимодействовать металлы, оксиды которых обладают амфотерными свойствами 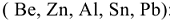 :
:
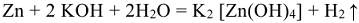
В реакции с водными растворами солей отрыв электронов от атома более активного металла осуществляется ионом менее активного металла, находящимся в растворе и выступающим в качестве окислителя:
Zn + CuSO4 = ZnSO4 +Cu
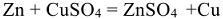
Характер взаимодействия металлов с кислотами зависит от температуры, концентрации, состава кислоты и восстановительных свойств металлов. Восстанавливать ионы водорода из разбавленных кислот способны металлы, электродный потенциал которых меньше потенциала водородного электрода:
Концентрированная серная кислота окисляет все металлы до высшей степени окисления с образованием сульфатов. При этом в зависимости от активности металла сульфат-ион восстанавливается преимущественно активными металлами 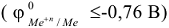
до 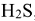 , металлами средней активности
, металлами средней активности 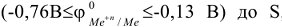 , малоактивными металлами
, малоактивными металлами 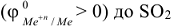 (табл.П7).
(табл.П7).
Например:
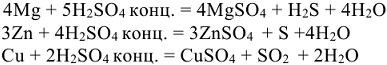
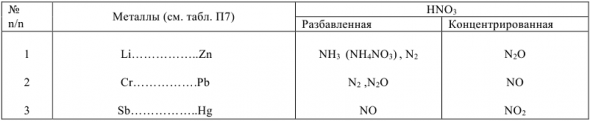
Азотная кислота окисляет металлы без выделения водорода из кислот. Глубина восстановления иона азота в азотной кислоте зависит от её концентрации и активности металла: чем выше восстановительная способность металла и более разбавлена кислота, тем глубже идет восстановление иона азота (табл. 12.1)
Таблица 12.1
Продукты восстановления иона азота  в азотной кислоте
в азотной кислоте
Пример:
Металлы в чистом виде применяются реже, чем их сплавы, обладающие более высокой прочностью, твердостью и коррозионной стойкостью. Из сплавов цветных металлов широкое распространение получили сплавы: меди с цинком — латуни, меди с оловом или алюминием -бронзы, меди с никелем — мельхиор.
Комплексные соединения
Комплексные соединения составляют наиболее обширный класс веществ, включающий неорганические: 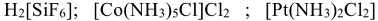 многие металлоорганические (трилон Б, оксалатный комплекс железа (III)) и биологические (гемоглобин, хлорофилл) вещества.
многие металлоорганические (трилон Б, оксалатный комплекс железа (III)) и биологические (гемоглобин, хлорофилл) вещества.
Сложные соединения, у которых имеются ковалентные связи, образованные по донорноакцепторному механизму, получили название комплексных или координационных соединений.Центральный ион, обычно положительно заряженный, называется комплексообразователем или центральным атомом (в вышеприведенных соединениях) комплексообразователями являются элементы 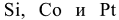 соответственно). Ионы или молекулы, располагающиеся в непосредственной близости к нему, представляют собой лиганды, которые образуют донорно-акцепторные связи с центральным атомом (в вышеприведенных соединениях лиганды —
соответственно). Ионы или молекулы, располагающиеся в непосредственной близости к нему, представляют собой лиганды, которые образуют донорно-акцепторные связи с центральным атомом (в вышеприведенных соединениях лиганды — 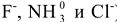 ). Комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения. При написании формулы комплексного соединения внутренняя сфера заключается в квадратные скобки. Заряд внутренней сферы рассчитывается как сумма зарядов комплексообразователя и лигандов. Внутренняя сфера может иметь отрицательный
). Комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения. При написании формулы комплексного соединения внутренняя сфера заключается в квадратные скобки. Заряд внутренней сферы рассчитывается как сумма зарядов комплексообразователя и лигандов. Внутренняя сфера может иметь отрицательный 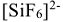 (комплексный анион) или положительный
(комплексный анион) или положительный 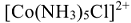 (комплексный катион) заряд, либо не иметь заряда
(комплексный катион) заряд, либо не иметь заряда 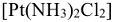 . Общее число
. Общее число 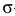 -связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального атома. Координационные числа комплексообразователей в соединениях:
-связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального атома. Координационные числа комплексообразователей в соединениях: 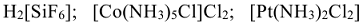 соответственно равны 6, 6 и 4.
соответственно равны 6, 6 и 4.
За пределами внутренней сферы комплексного соединения находится его внешняя сфера, содержащая ионы, заряд которых противоположен заряду внутренней сферы, так, чтобы молекула в целом была электронейтральна. В случае незаряженной внутренней сферы внешняя сфера отсутствует: 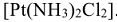 .
.
Название комплексного соединения образуется из названия аниона, за которым следует название катиона.
Пример: 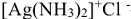 — хлорид диамминсеребра.
— хлорид диамминсеребра.
В комплексных катионах сначала называют отрицательно заряженные лиганды с окончанием “о” (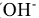 — гидроксо,
— гидроксо, 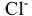 — хлоро,
— хлоро, 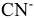 — циано,
— циано, 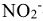 — нитро), затем нейтральные молекулы (
— нитро), затем нейтральные молекулы (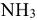 — аммин,
— аммин, 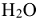 — аква). Перед названием лигандов указывают их количество греческими числительными (ди, три, тетра, пента, гекса и т. д.). Последним называют комплексообразователь, указывая степень его окисления римскими цифрами в круглых скобках. В названиях комплексных катионов используют русские названия металлов в родительном падеже.
— аква). Перед названием лигандов указывают их количество греческими числительными (ди, три, тетра, пента, гекса и т. д.). Последним называют комплексообразователь, указывая степень его окисления римскими цифрами в круглых скобках. В названиях комплексных катионов используют русские названия металлов в родительном падеже.
Возможно эта страница вам будет полезна:
| Заказать работу по химии |
Пример: 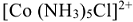 — катион хлоропентаамминкобальта (Ш).
— катион хлоропентаамминкобальта (Ш).
Название комплексного аниона составляют аналогично названию катиона, но степень окисления комплексообразоватсля указывают римской цифрой после его латинского названия с окончанием “ат”.
Пример: — 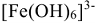 гексагидроксофсррат (III).
гексагидроксофсррат (III).
Названия нейтральных комплексных соединений без внешней сферы образуются также как и катионов, но комплексообразоватсль называют в именительном падеже, а степень его окисления не указывают, так как она определяется электронейтральностью комплекса.
Пример: 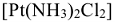 -дихлородиамминплатина.
-дихлородиамминплатина.
Диссоциация комплексного соединения на ионы внутренней и внешней сферы осуществляется необратимо и полностью, она называется первичной диссоциацией. Обратимая диссоциация комплексного иона внутренней сферы называется вторичной диссоциацией. Она характеризуется константой равновесия, называемой константой неустойчивости (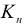 ). Чем меньше величина неустойчивости, тем прочнее комплексный ион.
). Чем меньше величина неустойчивости, тем прочнее комплексный ион.
Так, комплексный ион диамминсеребра диссоциирует:
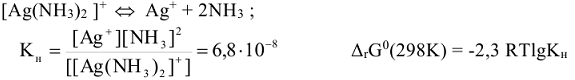
Процесс образования этого комплексного иона характеризуется константой устойчивости (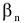 ), величиной, обратной константе неустойчивости.
), величиной, обратной константе неустойчивости.
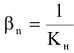
Вторичная диссоциация комплексного иона идет ступенчато, и каждой ступени диссоциации отвечает своя константа неустойчивости. Константа неустойчивости комплексного иона отражает суммарный процесс диссоциации и находится как произведение констант неустойчивости каждой ступени диссоциации.
Многие комплексы настолько прочны, что ионы в них нс обнаруживаются даже очень чувствительными качественными реакциями. Так, в соединении 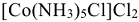 качественные реакции нс обнаруживают ни ионов кобальта, ни свободного аммиака. Количественный анализ показывает присутствие только 2/3 содержащихся в молекуле ионов хлора, т.е. только ионы хлора внешней сферы.
качественные реакции нс обнаруживают ни ионов кобальта, ни свободного аммиака. Количественный анализ показывает присутствие только 2/3 содержащихся в молекуле ионов хлора, т.е. только ионы хлора внешней сферы.
Жесткость воды
Одним из важнейших технологических показателей природной воды является се жесткость. Пройдя через известковые горные породы и почвы, вода извлекает растворимые гидрокарбонаты кальция, магния и железа (II), 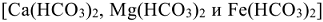 , а также сульфаты, хлориды, нитраты, силикаты, фосфаты этих металлов. При использовании жесткой воды в качестве теплоносителя на внутренних стенках паровых котлов и трубопроводов осаждаются малорастворимые карбонаты
, а также сульфаты, хлориды, нитраты, силикаты, фосфаты этих металлов. При использовании жесткой воды в качестве теплоносителя на внутренних стенках паровых котлов и трубопроводов осаждаются малорастворимые карбонаты 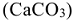 , основной карбонат магния
, основной карбонат магния 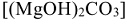 или гидроксиды магния и железа
или гидроксиды магния и железа 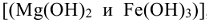 , образуя накипь. Накипь имеет низкую теплопроводность, поэтому вызывает местный перегрев стенок котла, что может привести к быстрому испарению воды и взрыву. Жесткую воду нельзя использовать для приготовления строительных растворов, она вызывает коррозию металлической арматуры, а так же приводит к увеличению расхода мыла (солей щелочных металлов высших жирных кислот)
, образуя накипь. Накипь имеет низкую теплопроводность, поэтому вызывает местный перегрев стенок котла, что может привести к быстрому испарению воды и взрыву. Жесткую воду нельзя использовать для приготовления строительных растворов, она вызывает коррозию металлической арматуры, а так же приводит к увеличению расхода мыла (солей щелочных металлов высших жирных кислот) 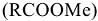 , идущего на связывание солей жесткости:
, идущего на связывание солей жесткости:
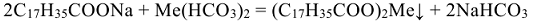 где:
где: 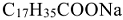 — стеарат натрия (твердое мыло),
— стеарат натрия (твердое мыло),
Жесткую воду перед использованием нужно «умягчить», т.е. уменьшить или устранить ее жесткость. По отношению к процессам устранения жесткости воды различают временную (карбонатную), постоянную (сульфатную и хлоридную) и общую (суммарную) жесткости воды.
Временная жесткость обусловлена присутствием в воде гидрокарбонатов кальция, магния и железа (II). При кипячении жесткой воды гидрокарбонаты солей разрушаются, переходя в малорастворимые соединения, выпадающие в осадок.
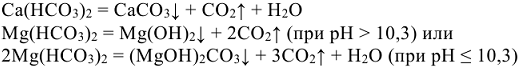
Распад гидрокарбоната железа (II) сопровождается полным гидролизом и окислением до бурого гидроксида железа (III) 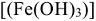 :
:
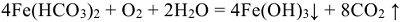
Для устранения карбонатной жесткости применяют также метод известкования, при котором в жесткую воду добавляют негашеную известь 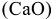 или гашеную известь
или гашеную известь 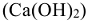 .
.
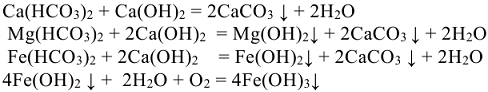
Часть жесткости, сохраняющаяся после кипячения или известкования воды, называется постоянной (некарбонатной) жесткостью. Она обусловлена присутствием в воде солей сильных кислот, главным образом сульфатов и хлоридов кальция, магния и железа (II).
Эта жесткость устраняется добавлением к воде соды 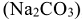 , ортофосфата натрия
, ортофосфата натрия 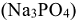 или тетрабората натрия, буры
или тетрабората натрия, буры 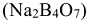 :
:
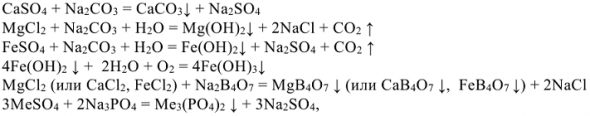
где: Me — металлы Ca, Mg, Fc
Одновременное прибавление извести и соды (известково-содовый метод) устраняет общую жесткость воды.
Одним из современных способов умягчения воды является ионообменный метод, при котором жесткую воду на конечной стадии очистки пропускают через твердые иониты, способные обменивать свои подвижные катионы  на катионы
на катионы  или подвижные анионы (
или подвижные анионы (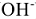 ) на анионы
) на анионы 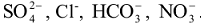
Катиониты — синтетические ионообменные смолы (КУ-1, КУ-2 и др.), сульфоугли и природные алюмосиликаты (цеолиты, глины, пермутиты), например, 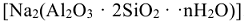 . Их состав можно условно изобразить формулой
. Их состав можно условно изобразить формулой 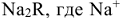 — подвижный катион, a
— подвижный катион, a 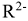 — анион. Схематически катионный обмен можно изобразить уравнением:
— анион. Схематически катионный обмен можно изобразить уравнением:
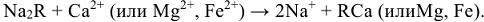
При этом ионы кальция, магния и железа переходят из воды в катионит, а ионы натрия из катионита в воду.
После использования большей части катионов натрия в процессе ионного обмена катионит обычно регенерируют, выдерживая в растворе хлорида натрия или соляной кислоты. При этом происходит обратный процесс:
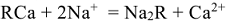
Регенерированный катионит может быть использован для умягчения новых порций жесткой воды.
Аниониты (АВ-16, АВ-17, АН-2Ф и др.) обменивают подвижный анион гидроксидной группы 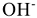 на сульфат-ион
на сульфат-ион 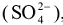 , хлорид — ион
, хлорид — ион 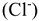 или нитрат-ион
или нитрат-ион 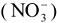 .
.
Количествснно жесткость воды (Ж) определяется суммарным содержанием миллимоль эквивалентов веществ, обуславливающих жесткость или веществ, прибавляемых для устранения жесткости по формуле:
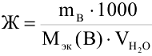
где 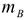 — масса вещества, г;
— масса вещества, г; 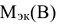 — молярная масса эквивалента вещества, г/моль.
— молярная масса эквивалента вещества, г/моль.
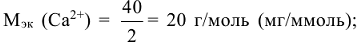
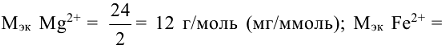
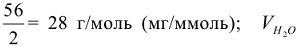 — объем воды в л; 1000 — переходный коэффициент от моль(В) к миллимоль (В). Молярная масса эквивалентов гидрокарбонатов
— объем воды в л; 1000 — переходный коэффициент от моль(В) к миллимоль (В). Молярная масса эквивалентов гидрокарбонатов 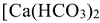 ,
, 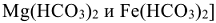 равна половине молярной массы этих солей.
равна половине молярной массы этих солей.
Карбонатную жесткость воды можно определить титрованием определенного объема воды раствором соляной кислоты 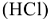 известной молярной концентрации эквивалентов
известной молярной концентрации эквивалентов 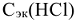 :
:
где: 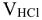 — объем раствора
— объем раствора 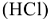 , пошедший на титрование, см3;
, пошедший на титрование, см3; 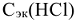 — молярная концентрация эквивалентов
— молярная концентрация эквивалентов 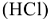 , моль/л,
, моль/л, 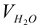 — объем исследуемой воды, см3.
— объем исследуемой воды, см3.
Общую жесткость воды можно определить титрованием воды раствором трилона Б (комплексона III), который является двузамещенной натриевой солью этилендиаминтстрауксусной кислоты (ЭДТА). Реакцию титрования можно изобразить уравнением:
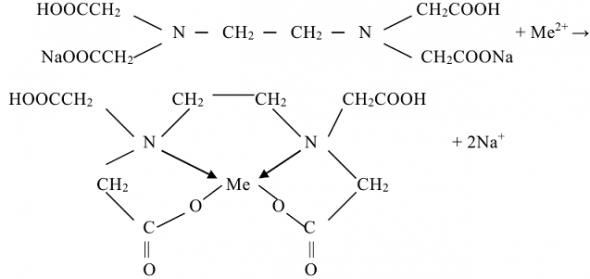
Метод основан на способности трилона образовывать с катионами металлов (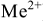 ) малодиссоциированные комплексные соединения.
) малодиссоциированные комплексные соединения.
Общая жесткость воды по трилонометрическому методу определяется по формуле:
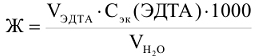
где: 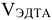 — объем раствора трилона Б,
— объем раствора трилона Б, 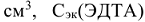 — молярная концентрация эквивалентов трилона Б, моль/л,
— молярная концентрация эквивалентов трилона Б, моль/л, 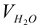 — объем исследуемой воды, см
— объем исследуемой воды, см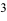 .
.
При использовании катионитов для устранения жесткости рассчитывают обменную емкость катионита (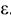 , ммоль/г или ммоль/см3), которая равна максимальному количеству миллимоль эквивалентов ионов
, ммоль/г или ммоль/см3), которая равна максимальному количеству миллимоль эквивалентов ионов 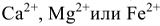 , поглощаемому 1 г. или 1 см
, поглощаемому 1 г. или 1 см катионита
катионита
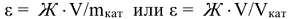 где
где 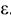 — обменная емкость катионита, ммоль/г или ммоль/см
— обменная емкость катионита, ммоль/г или ммоль/см ; Ж — жесткость воды, ммоль/л; V — объем воды, л;
; Ж — жесткость воды, ммоль/л; V — объем воды, л; 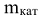 — масса катионита, г; VKar — объем катионита, см
— масса катионита, г; VKar — объем катионита, см .
.
Различают природную воду: очень мягкую — с жесткостью до 1,5, мягкую — от 1,5 до 4, средней жесткости — от 4 до 8, жесткую — от 8 до 12 и очень жесткую — свыше 12 ммоль/л. Жесткость воды в морях ~ 65 ммоль/л, в оксанах ~ 130 ммоль/л. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль/л.
Кстати дополнительная теория из учебников по предмету химия тут.
Высокомолекулярные соединения (полимеры). Способы получения. Свойства. Применение
К высокомолекулярным соединениям относятся вещества с большой молекулярной массой и особыми физико-химическими свойствами.
Существуют природные полимеры (натуральный каучук, белки, крахмал, целлюлоза и др.).
Синтетические полимеры получают 4-мя способами.
1. Полимеризация — процесс получения высокомолекулярных соединений, при котором макромолекула образуется путем последовательного присоединения молекул одного или нескольких низкомолекулярных веществ (мономеров) к активному растущему центру:
Общая схема полимеризации:
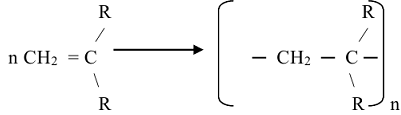
где R — атомы водорода или другие заместители,
n — степень полимеризации.
2. Поликонденсация — процесс получения высокомолекулярных соединений за счет взаимодействия функциональных групп мономеров с выделением низкомолекулярных побочных веществ.
В гомополиконденсации участвуют однородные молекулы мономеров, содержащие две различные по характеру функциональные группы. В гетерополиконденсации участвуют разнородные мономеры с двумя одинаковыми функциональными группами.
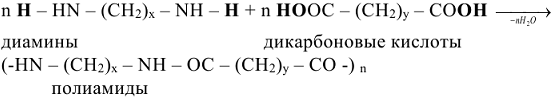
где х и у — число групп (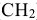 ).
).
3. При реакции полиприсоединения получение высокомолекулярных соединений происходит за счет перемещения подвижного атома (чаще атома водорода) из молекулы одного мономера в другую и соединения образовавшихся остатков (эпоксидные смолы, полиуретаны).
4. Методом химической модификации получают полимеры за счет взаимодействия функциональных групп исходных полимеров (производные целлюлозы).
Методом полимеризации можно синтезировать:
1. Полиэтилен: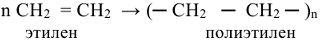
2. Полипропилен:
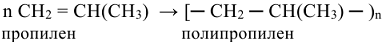
3. Полиизобутилен:
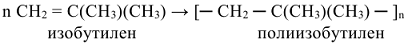
4. Полистирол:
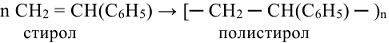
5. Поливинилхлорид:
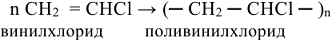
6. Полиакрилонитрил:
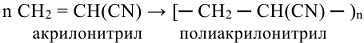
7. Поливинилацетат:
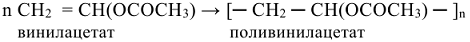
8. Полиметилметакрилат:
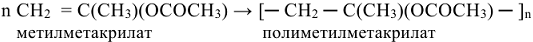
9. Политетрафторэтилен:
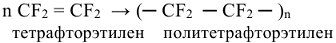
10. Сополимер акрилонитрила, бутадиена и стирола (АБС).
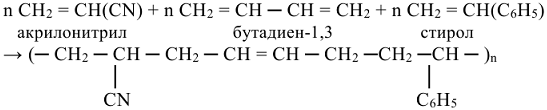
Методом поликонденсации можно синтезировать:
11. Фенолформальдегидный новолачный полимер:
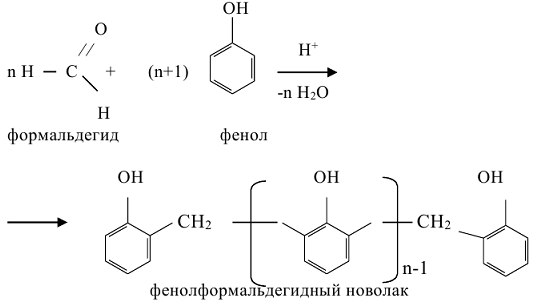
12. Полиамид-6:
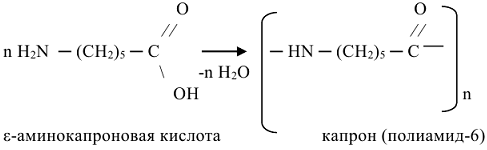
13. Полиамид-6,6

14. Полиэтилентерефталат (лавсан):
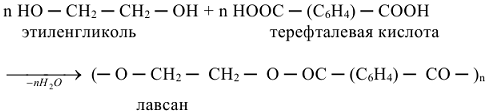
15. Кремнийорганический полимер (КО):
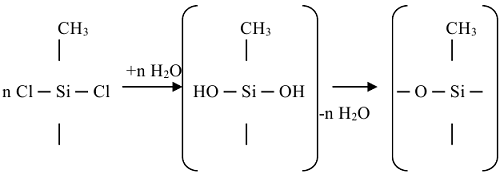
Методом полиприсоединения можно синтезировать:
16. Эпоксидный полимер (ЭД-смолу)
17. Полиуретан.
Эпоксидный полимер (начальные стадии реакции):
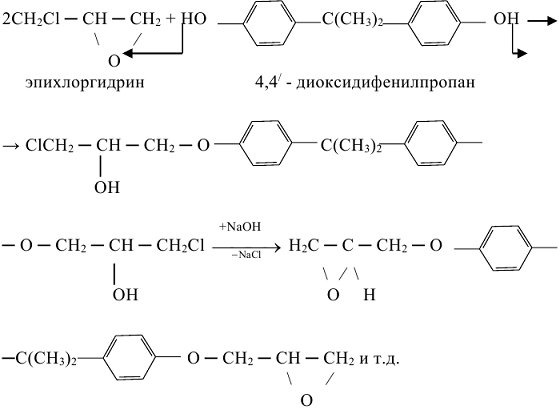
Полиуретан:
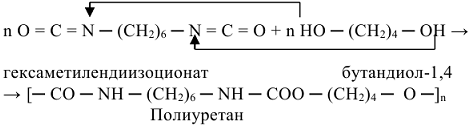
Методом химической модификации можно синтезировать:
18. Тринитрат целлюлозы.
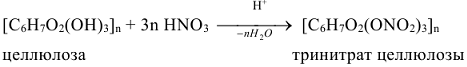
19. Триацетат целлюлозы:
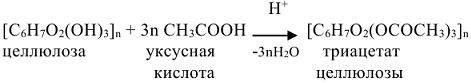
20. Карбоксиметилцеллюлозу:
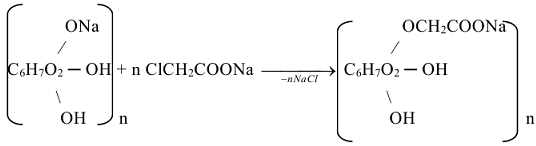
щелочная целлюлоза карбоксиметилцеллюлоза
где  — натриевая соль хлоруксусной кислоты.
— натриевая соль хлоруксусной кислоты.

