Оглавление:


Понятие о химической кинетике. Скорость химических реакций
- Понятие химической кинетики. Процент химических реакций. С термальным Невозможно проанализировать развитие этого процесса во времени. Потому что время (как переменная) не рассматривается в термодинамическом описании Поэтому 2-й этап изучения закономерностей химических веществ Этот процесс является долгосрочным аспектом развития. Основная задача химикатов kinetics.
- In реальная ситуация, поток химических веществ Реакция связана с преодолением энергетического барьера、 Это очень важно. Это термодинамика.. Химическая кинетика Помимо уточнения особенностей развития процесса во времени, ТИЦ Описание кинетики) также изучает механизм взаимодействия реагентов Атомно-молекулярный уровень (описание молекулярной динамики).
Отсутствие реализации этой реакции (AG <0) необходимо, но недостаточно Достаточные условия для реализации процесса на практике Людмила Фирмаль
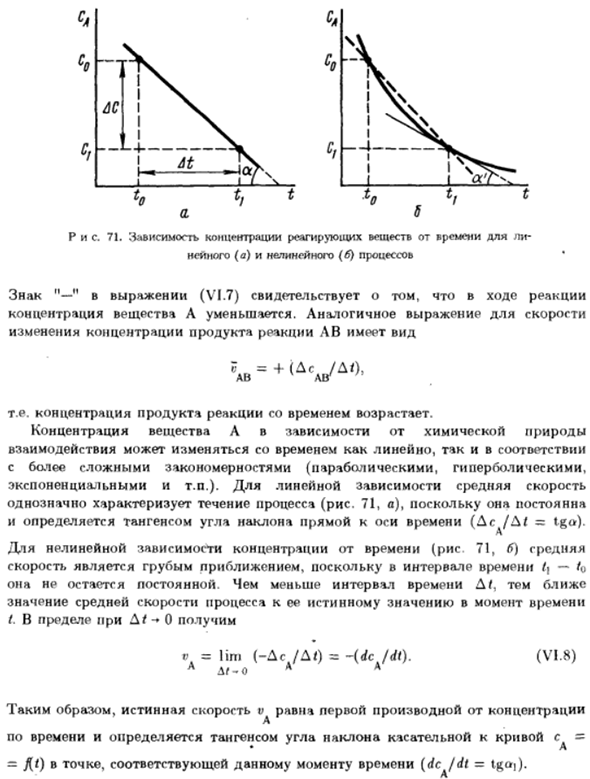
Оба направления Объяснения законов движения дополняют друг друга. Ранние и основные понятия химической кинетики Понятие скорости химической реакции. Скорость химической реакции Количество основных взаимодействий в единицу времени. Когда При взаимодействии изменяется концентрация реагирующего вещества, а затем скорость Реакцию обычно измеряют путем изменения концентрации реагента или продукта.
- Реакция в единицу времени. Вам не нужно следить за изменениями. Концентрация всех веществ, участвующих в реакции, так как она является стехиометрической Эта формула устанавливает зависимость между концентрацией реагентов. Рассмотрим уравнение равномерной реакции общего вида A + B = AB. Пусть будет так Эта реакция протекает в изобарно-изотермических условиях(p-const, T = = константа.)
Концентрация (моль / л) вещества а в момент времени 0 равна С0. Через некоторое время/ J ( <0), концентрация реагента A При образовании продукта AB уменьшается и становится равным c \ {c \ q-со В \ — ті-т0—кг:, 0 постоянного тока / в = Лим (- ас / в)=-(ДТ) А д ^ О А А а (Ви. Восемь) Во времени она определяется касательной наклона касательной линии к кривой= * Ля =Д<) в точке, соответствующей определенному моменту (dc / dt-tga]).
Таким образом, истинная скорость v равна производной концентрации 1-го порядка. Людмила Фирмаль
Смотрите также:

