Оглавление:









Подгруппа скандия и РЗЭ
- Подгруппы скандия и РЗЭ. Характер Список элементов в подгруппах скандия и РЗЭ. Элла Скандий объединяет подгруппы с типичными элементами и элементами Галлий подгруппы существование 3 валентных электрона. Но элемент ша- Группа валентных электронов состоит из 2 электронов на s орбиталях и 1 электрона на p орбиталях Для орбитали и элементов скандиевой подгруппы 3-й электрон находится на(n- 1) o ’ orbit.
- So типичные элементы и элементы подгруппы Гал Листья SP-элементов. Кроме того, элемент подгруппы скандия-это элемент СА ’.В 3 заряженные ионы группы SH E3 + элементное состояние электрона Существует состав благородных газов и поэтому горизонтальный аналог- Например, шестерни со щелочноземельными элементами в природе образуют оксиды Изменения в поведении гидроксидов и др.
Первый симметричный элемент, открывающий первую строку переходов Металл. Людмила Фирмаль
Обсуждаемая подгруппа также включает лантаноиды-14 элементов、 (n-2)/Орбита за пределами фонаря, характеризуемая населением. Всё. Лантаноиды с иттрием и лантаном называются редкоземельными элементами- Ми (РИ).Название происходит от средневекового названия природы Оксид — «почва» (и щелочноземельные металлы).Это не нормально Скандий элемент подгруппы скандия (Sc, Y, La) показывает свои свойства
Степень окисления составляет+3, а некоторые лантаноиды, кроме основного, указаны Состояния окисления +2 и + 4 все еще показывают различные состояния окисления. Получение природных соединений и металлов. Содержание скандия и редкоземельных элементов в земной коре не так уж и мало. В случае скандия это почти то же самое, что и в случае мышьяка、 Бор.1 общее содержание редчайших редкоземельных элементов Товарищи-Тулий-серебро, кадмий, ртуть, сепен и многое другое.
О Прогулки по природным миром, РЗЭ является первым, чтобы использовать се(лантана, церия, пр, НД личку、 Кроме того, он может использоваться в следующих типах устройств: (Sm) и иттрий (Y, Eu, Gd, Tb, Dy, но, Er, Tm, Yb, Lu).Этот отдел основан. О том, что церий содержится в основном в природных минералах Высокогорье, а другие-иттрий и другие элементы.
Скандий Имеет свой собственный минерал ScPCV2H2O (Стеллит), Sc2Si207 (приманка тотализатора)、 Это очень важно rare. In кроме того, скандий входит в состав цистоидита (SnC^). ВУЛЛУМИТ (Mn, Fe) WO4, урановая руда и др. Существует более 170 минералов. Триста сорок шесть Рыбный промысел, в котором РЗЭ содержится в разных пропорциях. Родственник Содержание каждого из них также отличается.
Меньше, чем другие, в том числе РИ Атомная масса большая, а серийный номер нечетный. От минералов группа rhium монацита (Ce, La, Nd,…это относится к Монацит sand. It содержит кварц, рутил и торий dioxide. In Монацитовый песок содержит все минералы семейства цериевых. Же элемент Группа представляет собой изоморфный фторуглерод (Ce, La,…он включен в FCO3 (сайт Bastone).
То же самое верно и для собственного силиката Ce2Si2O7 (целит).Из иттриевых минералов Группа-xenotime (Y, Eu, Gd,…) Обратите внимание на P04. Друг друга (как монацит). Для получения скандия его концентрат преобразуют в трифторид ScF3. Кальций термически восстанавливается до металла. Очищается дистилляцией Высокий vacuum. It было трудным химическим веществом, чтобы изолировать РИ в то время.
Техническое задание. Во-первых, у них так много химических свойств Подобного примера нет и в химии. Это особенно верно. Связано с химией лантаноидов. Это 3-е место Глубинный электронный слой атома (n-4), считая извне со значением Во-вторых, все РЗЭ очень тесно связаны с геохимией Это взаимосвязано. Наконец, в третьем случае не было никакого эффективного способа разделения. РЗЭ.
В основном используется неэффективно и неэффективно Фракционные кристаллы * за счет двойных сульфатов и нитратов РЗЭ. Результат、 Полученный мишметалл включает 40-45% Ce, 20-25% La, −15% Nd, −10% Другие редкоземельные элементы и до 5% Fe. Новейшие высокопроизводительные методы Хроматография и экстракция * * * * позволяют получать каждую РЗЭ Чистота 99,7-99,9%. Заключительным этапом процесса приобретения РЗЭ является один из следующих: Электролиз жара кальция или магния, или плавить хлорида фторида.
Чистота РЗЭ, полученного после переплава и перегонки в глубоком вакууме Она достигает 99,99%. Физико-химические свойства. Скандия и РЗЭ В виде простых вещей-серебристого металла, исчезающего в сырости Дух. Скандий имеет диморфизм: ниже 1334°С, в структуре ГПУ является стабильным. Когда эта температура превышена, существует решетка bcc. Все Rees имеют главным образом структуру Исключает графические процессоры (европий (bcc), иттербий (fcc) и самарий) Он имеет высокую ромбоэдрическую структуру.
Однако последнее можно считать Как слегка искаженный GPU. Металл семейства CE-пластик. Он мягкий, и чем выше атомный номер, тем выше твердость. Скандий и металл семьи иттрия несколько жестки. Исключение составляет Довольно податливый ytterbium. It имеет необычно высокое электричество Проводимость: 3 раза более высоко чем другие Rees, так, что- Фракционные кристаллы представляют собой способ разделения и очистки подобных смесей 1.
Используя несколько веществ кристаллизации. Хроматография-это метод разделения и анализа смесей на основе различных Распределение компонентов между 2 фазами: фиксированное (ионообменник и др.) и Подвижной (элюентом). * * * Экстракция-разделение смеси веществ и растворителя (экстрагента) Здесь компоненты смеси не растворяются одинаково.
Счетчик приближается к Меркурию. Скандий и редкоземельные металлы-парамагниты- Магнитная восприимчивость Sc, Y, и Lu очень weak. At в тот раз С другой стороны, Eu, Gd, Dy и Er при температурах ниже комнатной температуры обладают ферромагнитными свойствами、 Сетевой нейтралитет. Кюри A6°C является самым высоким только для Gd.
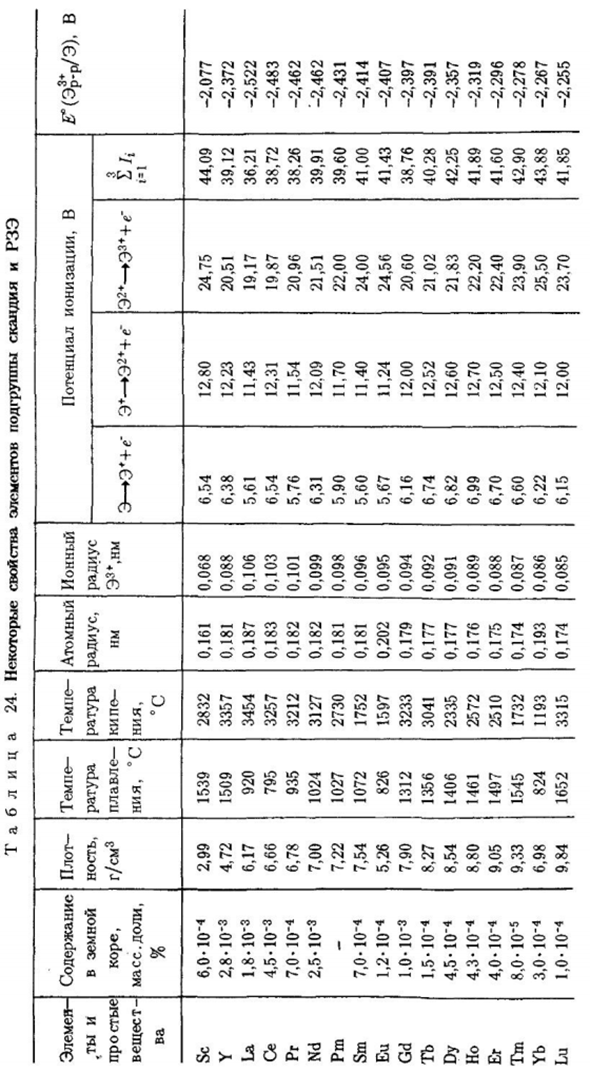
Забавный журнал Ды, в зависимости от температуры, имеет важные свойства. Проявляет характеристики парамагнетиков, ферромагнетиков и антиферромагнетиков.*В таблице. Некоторые особенности представителей 24 скандия и РЗЭ приведены в виде В одиночку, и как элемент группы SHV. Распространенность Элементы подгрупп скандия и лантаноидов следуют общей схеме Тая: больше элементов с четным порядковым номером, чем странно Z.
Скандий и иттрий-самые простые вещи В то же время это самый тугоплавкий материал. В зависимости от температуры плавления Только лантаноиды тулия и лютеция являются better. In в целом, характер изменений Температура плавления лантаноидов выявлена внутренне циклически Температура плавления европия и иттербия в носу самая низкая. Реализованы стабильные электронные конфигурации 4fbd°6s2 и 4 / 45i°6s2 Вы можете также для того же элемента, увеличить атомарное значение Mustache.
In другими словами, атомы европия и иттербия имеют простое тело между собой Из-за стабильности электронной конфигурации он взаимодействует более слабо、 Больший размер атома по сравнению с другими такими же атомными соединениями Что я должен сказать своему врачу, прежде чем принимать это лекарство? Лантан с относительно низкой температурой плавления、 CE и празеодим имеют высокую температуру кипения, а именно Он летуч (аналогия с галлием).
В то же время, тот же европий и Иттербий в ряду лантаноидов имеет минимальную температуру кипения-большую Более изменчивый. По химической активности скандий и РЗЭ сопоставимы со щелочноземельными. Металл. Стандартный потенциал электрода от −2.08 (Sc) −2.52 В (Ла).Скандий не растворяется в воде из-за наличия пленки. В воздухе образовались оксиды.
Остальные металлы подгруппы скандия Лантаноиды яростно разрушают воду. SC и РЗЭ растворяют в разбавителе Кислоты, кроме плавиковой и фосфорной (за счет образования нерастворимых веществ) Фосфаты.) Ви скандий и РИ примерно одно и то же、 Она варьируется от 1,2 до 1,3.Эти элементы взаимодействуют с большинством металлов. И неметаллический. Характерные соединения. Характеристика Оксиды скандия и РЗЭ являются наиболее прочными соединениями кислорода- отрицательная энтальпия их образования значительно больше、
Больше чем глинозем (°, 2d&= −1675.7 kJ / mol): Соединение S102O3 В°, 298,кДж / моль −1908.3 Соединение Чч ^ Оз В°, 2D и кДж / моль-1820.5 Y2O3 −1904.1 Dy2o3 −1862.7 Стекол la2o3 −1794.9 Er2o3 −1893.7 Nd2o3 −1808.3 Yb2o3 −1814.6 Eu2O3 −1661.1 Lu2O3 −1878.2 * Антиферромагнетик-это магнитный момент атома Потому что соседние узлы кристаллической решетки ориентированы в обратном порядке、
Интегральная намагниченность мала. Ла 4/5#6 ^ ^ Бесцветный Нью-Йорк + 3 −1653.9 Се 4/5 Р Р < Бесцветный Нью-Йорк + 3,+ 4 −1642.2 РГ 4/5 Пв2 Желтый Белье +3(+4) −1634.2 Nd 4/5 ″ Рв2 Redfive. Нарядный. +3 −1637.2 РТ 4/5 ^ Б * 2 Розовый +3 −1611.2 См 4/5 ″ РБ * 2 Желтый +3(+2) −1629,2. Сравнение тепла, производимого E ^ Oz、 Линия характеризуется оксидами лантана и europium. At в то же время, энтальпия Образование оксида европия называется А! Почти то же самое, что и образование 2Oz, и оксидов Фонарь превышает его более чем на 100 Дж / моль.
Поэтому среди персонажей Из тройных оксидов лантаноидов прочность оксида самая низкая Хотя сам европий относится к разряду таких мощных соединений、 A12Oz и так далее on. In кроме того, энергия активации окисления обычно такова Многие из них нестабильны даже в нормальных условиях. Фонарь Например, хранить в бензоле, чтобы предотвратить окисление в воздухе. Окись скандия и РЗЭ бесцветна (почти) и огнеупорна、 Водорастворимое вещество, но интенсивное(с выделением тепла)
Он действует с образованием характерного гидроксида е (он).Половина. Они окисляются путем сжигания соответствующих гидроксидов, нитратов и углерода За счет действия щелочного раствора на растворенные в воде соли получают гидроксиды. Скандий и РИ. Кроме того, гидроксид почти нерастворим в воде. Сканирование подгрупп. Растворимость гидроксидов увеличивается: КС(ОК-ППР 28,г (ОК-ППР 22.8、 Ба (о)с-ппр 18.9.И все гидроксиды лантаноидов характеризуются приблизительно
То же растворимость в г (ОХК (приказ ППР 22-23). Вид скандия представляет собой амфотерный электролит с более выраженными основными свойствами、 Гидроксид РЗЭ является довольно сильным основанием. в локальной сети В случае таноида основная прочность гидроксида постепенно уменьшается по мере его уменьшения Радиус 3i +в результате усадки лантаноида. Восстановление ионов Они в радиусе увеличивают ионный потенциал и связь с кислородом становится больше Он прочен.
Поэтому гидроксиды иттербия и лютеция слабы Она в этом отношении бисексуальна и примыкает к BS (OH). Три галогенида характерных скандия и РЗЭ, в отличие от аналогичных Подгруппа соединений элементов тугоплавких и твердых летучих веществ галлия. Триф Краситель практически нерастворим в воде, а остальные например Не только на воде, но и на низкосортном алкоголе.
Ниже приведены трифторандальпы Элементы и оксиды скандиевой подгруппы выше, чем элементы и оксиды РЗЭ Следующие характеристики: Соединение Диджей кДж / моль-648.9 Соединения GdF3 Д#\ кДж / моль −1713.3 Yf3 1718,3 Dyf3 1719.6 Laf3 −1731.8 Erf3 −1722.5 Ndf3 −1712.9 Ybf3 −1656.9 EuF3 −1619.2 LuF3 −1700.8 Теплота образования трифторида несколько уступает теплоте образования оксида.
Но проблема хлорида и бромида почти в 2 раза Лантаноиды ЕС 4 / 5д°6с2 Почти ничего. Цвет + 3,+ 2 −1537. Шесть Gd 4/5 < / 16s2 Бесцветный Нью-Йорк +3 −1637.2 Терабайт 4/5 PCs2 Бесцветный Нью-Йорк + 3,+ 4 −1631.3 Умри. 4/05 <P6s2 Желтый Белье +3(+4) −1642.6 Отель 4/15 <f6s2 Кори Ченг Желтый + 3 −1637.2 Ух… 4 / 25д°6с2 Розовый + 3 −1621.3 Торговая марка 4/35 < f6s2 Бледно-зеленый Белье + 3(+2) −1617.9 Терабайт 4/45 <f6s2 Бесцветный Нью-Йорк + 3,+ 2 −1581. Один Elements.
In скандиевая подгруппа, естественное влияние образования ЭХЗ Растворенные, в ряду лантаноидов, наблюдается довольно слабое непрерывное снижение Уменьшение жары произведенной всем Галоидом EH3.Естественно, от фтора Теплота образования йодида снижается во всех элементах. С сильной жарой В воздухе, три-фторид сперва преобразован к оксофториду 90Ф、 К оксиду.
- Для хлоридов аналогичное превращение наблюдается при нагревании. Кристаллогидрат. В химии редкоземельных элементов наиболее заметны внутренние Периодичность, особенно для производных характерной степени окисления Ния. Описание этого факта можно найти в гл. X. объясните внутренние органы Периодичность составления таблицы. Рисунок 25 гидратированного Иона Э3+, ста-
Стандартная энергия Гиббса и кажущаяся степень окисления образования трифторида Лень. Каждые 7 составляют внутренний период、 Третичный потенциал монотонно возрастает(см. таблицу 24) Уменьшение атомного радиуса за счет сжатия лантаноида. Но начало было положено Новый внутренний период (переход от нее к ГД) сопровождается уменьшением 4 3-й потенциал ионизации в V.
Вы можете увидеть удивительные сходства в свойствах расположенных элементов Друг под другом. Людмила Фирмаль
Впервые в первых 7 случаях европия Достигается стабильная наполовину заполненная оболочка 4/.Гадолиний В той же стабильной 4 / оболочке, 5 появится 1 электрон (/- оболочка、 Это гораздо легче удалить, потому что этот электрон стабилен 5 (нестабильный / °shell. In случай элементов, следующих за Gd, наблюдается снова Монотонное увеличение потенциала 3-й ионизации фонарем сжатие среды IDE.4 из европия / часто из-за стабильности оболочки 6v2 состояние окисления+2 электронами, а 7 1 непарными 4 / электроны на оболочке участвуют в образовании связей в более жестких условиях Wii.
As для аналогов иттербия фото аналогично, но только стабильно Появится полностью сидящая оболочка 4/4.Для Самария и тулия. Слева от EY и Yb, Ap и 4/3 оболочек выше Уменьшение в стабильном состоянии, и поэтому главным образом указывает на характеристику Степень окисления. Но эти же элементы в мягких условиях 6с2 электронов с метастабильными АП результат в состоянии окисления+2 4/3 оболочки.
Элементы начала внутреннего периода-La и Gd-наблюдения При стабильности оболочки Af и 4 / g дается только состояние окисления+ 3. Он полностью пуст или наполовину заполнен. И задействованные электроны В МИ химических взаимодействий, они имеют 5 <Rb2a электронов. 3. Электронный. Заполненные орбиты bv являются Он стабилен, но в случае лантаноидов и лантаноидов их электроны находятся снаружи、
Поэтому сцепление с сердечником слабое, и в результате его становится больше mobile. In 351. ! ’/ < CE и тербий против стабильных 4/3 и 3 после фонаря и гадолиния Оболочка 4 / g появляется сразу до 2 «лишних» электронов в результате перехода 5</ — появление 1 электрона с траекторией и следующего. С этими 2 электрона Плюс 6 * 2 к орбите, определить степень окисления+4, а с церием Его производные показывают самое высокое состояние окисления+4 точно.
Это нехарактерно для максимальной стабильности совершенно бесплатно Ной 4 / * — оболочка. Для Pr и Dy степень окисления+4 равна、 4 / — по сравнению с предыдущими элементами с момента увеличения численности населения Орбиты, вызванные неспаренными электронами, делают их более стабильными. Обращает на себя внимание почти идеальное сочетание гидратов цветов Ион аналогового элемента (Диада). на самом деле, мы говорим о цвете. Водный Комплекс Е3+.
Цветовая аналогия между ними такова、 Механизм образования комплексов с молекулами воды и характер их вовлечения Траектории Ron /-и d двойных элементов одинаковы. Конечно, об этом трудно говорить Полное согласование энергии Гиббса с образованием трифторида Они есть amazing. In кроме того, энергия Гиббса в формировании от элемента к элементу Лантаноиды Та же химическая активность.
Но человек должен четко обращать внимание на то Заниженное значение указанной характеристики для закрытия каждого Ранние периоды элемента-европий и иттербий. Интерпретация этого факта То же самое-половина стабильности и полностью оборудованная 4 / javital, в чем проблема- Эти элементы менее активны по отношению к акцептору электронов. Поддерживать. Чистый 4f и 4 / Shell также имеет La и Gd и начинается с 7 Элементы.
Но эти элементы, в отличие от Ey и Yb, имеют 1 электрический Ну, 5 (yerbital, 6v2 вместе с электронами, чтобы определить электричество Полезная деятельность. Поэтому последний лантаноид-Лютеций — не вписывается в семерку Это элемент, а не часть Диад. В нем на 4/4 полностью-и заполнил Орбиты 6v2 имеют 5 электронов в 1-й I-оболочке.
Таким образом, Лютеций является Поместите его под иттрий и удалите элемент с серийным номером из системы 57 (La) — 70 (Yb). в этом случае внутренний цикл лантаноидов является полупериодом Это дает более строгую формальную основу. Соединения с другими неметаллами. Скандий, европий、 Гидрид иттербия состава англ Электропроводность. Из-за их физико-химических свойств、 Является металлоподобным гидридом, и поэтому официально только Он подобен гидридам, таким как соли щелочноземельных металлов.
Остальная часть РИ Образует гидриды ENg и ENz-последний также является интерстициальной фазой Как рений metal. In в случае лантана гидрид является наиболее стабильным Синтетические LaH2r5, которые можно рассматривать как решение равенства лаборатории И взрыв. Гидрид ENZ легко гидролизуется. Сульфиды скандия и РЗЭ, 3S, 32Sy, gross ^Б^, Эг8з、 3С2.Большинство сульфидов являются фазами различного состава、
Соединение металла type. In много Rees, тугоплавкие моносульфиды характерны. Сырье, которое кристаллизуется в кубической структуре. Около 9S в сульфиде Окисление РЗЭ +2-это чисто формальность. Сероводород и водород являются released. It правильнее рассматривать их как этапы реализации 32s3 металл. Состав селенидов и теллуридов в большинстве случаев соответствует формуле 352. 3Se (Te) или E28e (Te) h. только при сплавлении CE и теллура Цетег.
В отличие от сульфидов, селенид является водостойким и только разрушается. Кислота. Когда тип 32se3 селенида нагрет к 1200-1700 ° С, он сделан секретным Селен и металлический блеск входят в селенид Ez8e4. Нитрид 3N кристаллизуется в кубической структуре. Они очень несговорчивы Ki, например, ScN плавится при 2900°С. Нитриды уже гидролизуются во влажном состоянии Воздух, в котором выделяется аммиак.
Он также известен как фосфид Er-типа. Структура NaCl. Когда компонент сплавляется, изоморфизм легко формируется. Арсениды, фосфиды и фосфиды. Запомните элементы подгруппы Висмут-галлий не образуется. Композиции желтого карбидов ES2 прекрасно. Когда он гидролизуется, он высвобождается. Ацетилен является доминирующим углеводородом.
Скандий и карбид ScC2 формирует темно-серый SC4C3 подобный к алюминиевому карбиду AI4C3. Сплав скандия и большинства компонентов при высоких температурах Были получены РЗЭ моно и дисилицид 9Si и 3Si2. Содержание кремния невелико. Для скандия, иттрия и лютеция получены бориды EVg. Самым стабильным гексагидратом Евы был obtained. In кроме того, о многих Rees Известны EV4 и EV12, а также фазы, богатые бором.
Все они Как металл, тугоплавкое Б000-2500°к), высокое электричество Проводимость и твердость. Соли кислорода и комплексные соединения Неня. Для скандия и РЗЭ наиболее характерны кислородсодержащие соли. Кислоты и комплексные соединения на их основе. Нитраты и сульфаты растворимы Оно главн к карбонатам и фосфатам внутри water. It интересно отметить растворимость С увеличением количества Rees, нитраты сначала уменьшаются, затем Он будет расти again.
As в результате минимальная растворимость уменьшается до Cc1AcO3) s- Растворимость щелочноземельного элемента, а также растворимость сульфата Уровни сульфатов в подгруппе скандия снижаются сверху вниз. Скандиевая соль、 Иттербий и Лютеций чувствительны к гидролизу из-за их амфотерной природы. Вид. Скандий и иттрий, как и алюминий, образуют сложные фториды [9F6] 3 -, и двойн-соль с сульфатами алкалиа, нитратами, карбонатами Металлические композиционные способности, такие как тип MegZS ^ — ег ^ о ^ ы Лантаноиды маленькие.
Это связано с негативным воздействием на орбитальный гибрид. Для электронизации помещают готовую оболочку 4 / Тоже deep. In кроме того, орбиты 5rf, 6s и br (для ионов E3 +) являются Он почти не участвует в осложнении. Таким образом, доминирующим Факторы образования комплексных соединений РЗЭ остаются электрическими Е3 +статическое притяжение между ионами и лигандами. Но стабильность комплекса Резкое увеличение расхода при взаимодействии Е3 +с анионами поликарбоновых кислот С образованием кислотных комплексов.
Таким образом, комплекс диспрозий оксалат [Oy (C2O4) g] «10.4 pA’ nest, образование циклического хелатного комплекса Типы повышают стабильность на много порядков, например[T) y (EDTA)]. па’Нест 17.98. Соединения со степенями окисления+4 и+2.Некоторые В лантаноиде, помимо характерной степени окисления, присутствуют+ 4 и+2. Церий выделяется среди лантаноидов, проявляющих степень окисления +4. Относительно стабильное соединение в состоянии окисления+2 евро- Пий.
Диоксид сео2 образуется при непосредственном взаимодействии компонентов Он кристаллизуется в структуре fluorite. It плавится при температуре 2600°C под давлением Кислород, начать отделение кислорода только при 2300°C. At 1250 ° С Сеог восстанавливается до Се2о водородом;).Диоксид церия не плавится в воздухе. В воде и после выпечки присутствуют как кислоты, так и щелочи. — Сеог силен. Например, окислители выделяют хлор из соляной кислоты. 2СеО,+8НС1=2СеС13+С12+4Н2О
Синтез диоксида церия с оксидами или карбонатами активных металлов Тип Me2Ce0s-гидроксид Ce (OHL приводит к образованию Церата в пресс-форме без растворения Он содержится в воде (РПР 50). в щелочи, а при растворении в водном растворе кислоты Образование аква комплекса вызывает розовый раствор [Ce (H2O) 8] 4 *. Нагретых металлических тербия и празеодима на воздухе、
Смешанные оксиды Thb (ThBr3Or3 (ZrbOr) и Pr7O12(Brr3Ob3r3Orr? это не. Двуокиси Тербий нестабилен. Диоксид Prg-черно-коричневые кристаллы структуры Типа флюорита разлагается уже при 400°С. Это сильный окислитель: окисляет Перманганат из соли Mn (+2). Из четырех галогенидов известно только 3F4.Сео4 получают путем растворения Сеог.
Плавиковая кислота, бесцветный порошок, который разлагается При 390°C; TbF \ j может быть получен окислением трифторидов фтором. Желтый Крис TbF4 tall растворяется при 180°C; известны некоторые бесцветные PrF4 при температурах 90°C разборка Из солей оксигенированной кислоты известны только производные церия. Сульфат церия (SO4J, CeOg) был термически обогащен Серная кислота. Растворим в CE (SO4J-желтый порошок, Вода. Из водного раствора выделяется в виде розовых кристаллов 8 молекул.
Вода ламы. Известны только основные нитраты и карбонаты: Ce (OH) (GYuz) s и Ce2(OH) g (COz) i-в то же время, Ce (+4) образует стабильные ацетаты и перхлораты. Се (сн3соо), се, се (cy4l). Катион Ce4 +обладает большим ионным потенциалом、 Способность к образованию комилекса несколько выше, чем у других лантаноидов Состояние окисления+4.In кроме того, лучшее состояние окисления является более стабильным По сравнению с первичными соединениями.
Следовательно, Ce(+4) Стабильные комплексы[Ce (CrO4) 3] 2-и[Ce(NOsN] 2 \из Галогенидных комплексов Наиболее стабильный фторид: [3Fg] 2 «(Ce и Pr), [3F7] 2″(Ce, Pr, Tb) и Диспрозий известен только по Csa [DyF7]. Степень окисления +2 является наиболее характерной для европия. Отопление Темно-коричневый оксид EuO — в воздухе Eu2O3, содержащий графит до 1700°C Монооксид европия-термостойкий кубический-медленное разложение-
Это вода с образованием водорода, то есть мощный восстановитель. Знаменитый Существуют также нитриды Самария и иттербия структурного типа NaCl. Восстанавливать Понижая EuFg с 1000 ° С водорода, можно получить дифторид EuF-2. Изоморфизм с CaF2.Известны дихлорид, дисбовл, дисбонид Sm, Eu, Tm и Yb. Стабильность в указанном ряду лантаноидов уменьшается слева направо. Естественно, от хлорида до йодида.
Триста пятьдесят четыре МИССУРИ’ Катодное восстановление сульфата E (+3) белый EuSO4, получил свет Зеленый YbSO ^и SmSO4 в красном цвете. Сур. Тюк Е (+2) плохо растворим в воде. Например, для EuSO4 RPR 10.EuSO4 Изоморфизм к BaSO4.In генерал, она химик Состояние окисления+2 очень похоже Химия щелочноземельных элементов. Всё. Степень окисления производных РЗЭ+2 Это восстановитель. \ 1 ettalo х и М и И. В металле Различия между элементами подгрупп Галлий и скандий Очевидно.
Металлы подгруппы галлия (.SjP металл) не образуется непрерывно Твердый раствор, элементы подгруппы Скандий предлагает неограниченные решения Много твердых мостов Металл. Поэтому иттрий образуется непрерывно Твердый раствор, содержащий скандий, лантан, Титан, торий и гадолиний Кроме того, металл подгруппы » отличается от галлия и галлия、 ГД)на диаграмме состояния дают большую площадь твердого тела с границей The solution.
It необходимо подчеркнуть, что это точно в химии металлов элементов Скандий группирует характеристики как первый представитель каждого Какого-то переходного РФ elements. In нормальная химия, поведение</-• Пораженные элементы, как правило, начинаются с подгруппы титана. Скандий и РЗЭ взаимодействуют со щелочными металлами. А если сплавить Часто наблюдается разделение слоистых металлов в жидком состоянии.
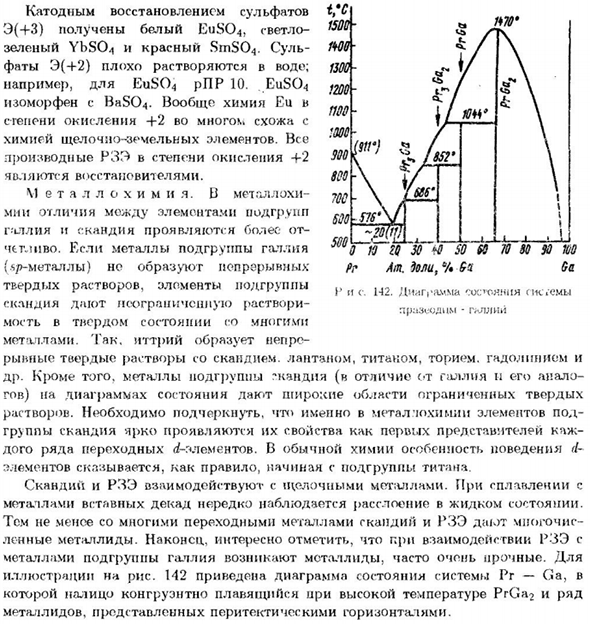
Тем не менее, во многих переходных металлах скандий и РЗЭ имеют много Лен. Наконец, при взаимодействии с РЗЭ、 Металл в подгруппе галлия часто производит очень сильные металлиды. Для Рисунок 142 представляет собой диаграмму состояния системы Pr-Ga. PrGa2 плавится при высоких температурах、 Металлид представлен перитектической горизонтальной линией.
Смотрите также:
| Алюминий | Углерод |
| Подгруппа галлия | Кремний |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.

