Осмос
Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называют осмосом.
Данный процесс обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя.
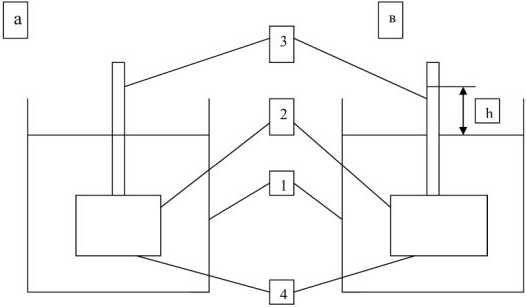
рис. 5. Схема осмометра.
Возьмем сосуд 2 дном которого служит полупроницаемая мембрана 4, переходящий в узкую вертикальную трубку 3. Наполним его раствором сахара и погрузим в сосуд 1 с водой. Первоначально уровень в сосуде 1 и трубке 3 будет одинаковой ( рис. За ) Вследствие осмоса объем раствора в сосуде будет постепенно увеличиваться и раствор начнет заполнять вертикальную трубку. По мере поднятия уровня раствора в трубке будет создаваться избыточное давление водяного столба (гидростатическое давление), измеряемое разностью уровней жидкости и противодействующее проникновению молекул воды в раствор (рис. Зв).
Когда гидростатическое давление достигнет определенной величины, осмос прекратится — наступит равновесие. Гидростатическое давление станет равным тому давлению, которое является количественной характеристикой процесса осмоса, — осмотическому давлению. Оно равно давлению столба раствора в осмометре высотой h. Если внешнее давление, приложенное к более концентрированному раствору, выше осмотического, т.е. 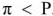 , то скорость перехода молекул растворителя из концентрированного раствора будет больше, и растворитель будет переходить в разбавленный раствор — обратный осмос.
, то скорость перехода молекул растворителя из концентрированного раствора будет больше, и растворитель будет переходить в разбавленный раствор — обратный осмос.
Вант — Гофф установил, что величина осмотического давления равна величине давления, которое оказывало бы растворенное вещество, находясь в газообразном состоянии и занимая весь объем раствора. Давление, которое оказывает вещество находящееся в газообразном состоянии можно рассчитать используя уравнение состояния идеального газа (уравнение Менделеева -Клапейрона):
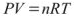
где: п — количества моль идеального газа;
R — газовая постоянная, R = 8,314 л • кПа/моль • К;
Т — абсолютная температура, К;
V — объем газа, 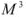 ;
;
Р — давление газа, Па.
В разбавленных растворах неэлектролитов свойства растворов нс зависит от межмолекулярного (межионного) взаимодействия, а определяется только концентрацией растворенного вещества ( аналогично идеальным газом ). Поэтому для описания таких растворов возможно применение уравнение Менделеева — Клайперона, тогда если заменить давление Р на осмотическое давление 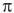 и объем раствора V выразить в литрах, получим:
и объем раствора V выразить в литрах, получим:
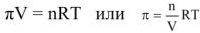
Откуда 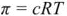
где:
с — молярная концентрация раствора, моль/л;
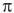 — осмотическое давление, кПа;
— осмотическое давление, кПа;
R — газовая постоянная, R = 8,314 лкПа/моль*К
Т — абсолютная температура, К.
Растворы с одинаковым осмотическим давлением называются изотоническими.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Эбуллиоскопический закон |
| Криоскопический закон |
| Гальванический элемент в химии |
| Зависимость величины электродного потенциала от концентрации ионов и температуры в химии |

