Методы умягчения воды
Умягчением воды называется процесс, приводящий к снижению жесткости, т.е. уменьшению концентраций кальциевых, магниевых и железных солей.
Существует несколько методов умягчения воды. Выбор того или иного из них определяется главным образом необходимой глубиной умягчения (предельной величиной остаточной жесткости), качеством исходной воды и экономическими соображениями.
Для умягчения воды применяют:
1) термические методы, основанные на нагревании воды до кипения;
2) реагентные методы, при которых находящиеся в воде ионы 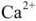 ,
, 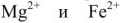 связываются определенными реагентами в практически нерастворимые соединения;
связываются определенными реагентами в практически нерастворимые соединения;
3) метод ионного обмена, основанный на фильтровании воды через специальные материалы, обменивающие входящие в их состав ионы 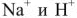 на ионы
на ионы 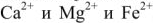 , содержащиеся в воде, а анионы
, содержащиеся в воде, а анионы 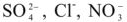 ,
, 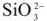 -на гидроксид-ионы
-на гидроксид-ионы 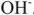 .
.
Термический метод. Умягчение воды кипячением основано на сдвиге углекислотного равновесия в сторону образования менее растворимых средних карбонатов или гидроксидов 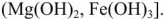 ,
,
При наличии гидрокарбоната кальция 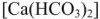 протекает реакция:
протекает реакция:
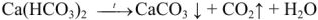
Кипячением можно удалить углекислый газ и намного снизить карбонатную кальциевую жесткость, однако полностью ее устранить не удается, т.к. СаСО3, хотя и незначительно (13 мг/л при 18°С) растворим в воде. 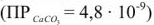
При наличии в воде гидрокарбоната магния 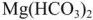 вначале образующийся карбонат магния
вначале образующийся карбонат магния 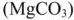 , сравнительно хорошо растворимый (ПО мг/л), подвергается гидролизу с образованием малорастворимого (18 мг/л) гидроксида магния
, сравнительно хорошо растворимый (ПО мг/л), подвергается гидролизу с образованием малорастворимого (18 мг/л) гидроксида магния 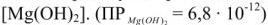
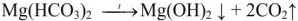
Превращения гидрокарбоната железа (II) 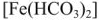 сопровождается полным гидролизом до
сопровождается полным гидролизом до 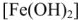 и затем окислением до бурого гидроксида железа (III)
и затем окислением до бурого гидроксида железа (III) 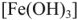 :
:
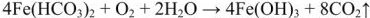
Желтоватый цвет накипи свидетельствует о наличии в воде растворимых солей железа.
Реагентное умягчение воды. При реагентном умягчении вода обрабатывается веществами, связывающими находящиеся в воде ионы 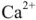 ,
, 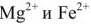 в труднорастворимые соединения. В качестве реагентов применяют известь
в труднорастворимые соединения. В качестве реагентов применяют известь 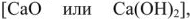 , соду
, соду 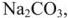 известь и затем соду (содоизвесткование), ортофосфат натрия
известь и затем соду (содоизвесткование), ортофосфат натрия 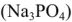 или буру
или буру 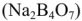 .
.
Известь является одним из наиболее дешевых реагентов. 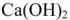 образует труднорастворимые соединения по следующим уравнениям:
образует труднорастворимые соединения по следующим уравнениям:
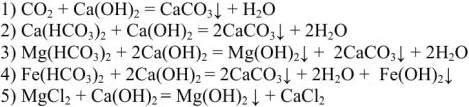
Из уравнения (5) видно, что в результате реакции вместо постоянной магниевой жесткости образуется постоянная кальциевая жесткость.
Содовый метод. Оставшиеся после известкования соединения реагируют с содой
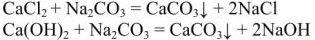
Итак, методом содоизвесткования снижается и карбонатная и некарбонатная , т.е. общая жесткость воды. Однако, полностью устранить жесткость этим методом не удается из-за некоторой растворимости 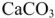 и
и 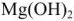 , которые к тому же легко дают коллоидные растворы и процесс образования осадка идет недостаточно быстро. Доумягчение воды проводят фосфатированием, добавлением буры:
, которые к тому же легко дают коллоидные растворы и процесс образования осадка идет недостаточно быстро. Доумягчение воды проводят фосфатированием, добавлением буры:
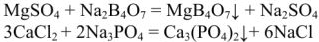
Это методы глубокого умягчения воды (до 0,03-0,07 ммоль/л) применяются после предварительного умягчения другими, более дешевыми способами.
Метод ионного обмена. Рассмотренные выше термический и реагентные методы обработки воды не позволяют снизить жесткость воды до нормы качества питательной воды современных парогенераторов. Эта цель достигается обработкой воды методом ионного обмена, который позволяет получить воду, полностью освобожденную от ионов накипеобразователей. Метод ионного обмена основан на способности некоторых высокомолекулярных соединений (природных или синтетических), практически нерастворимых в воде, вступать в обратимые реакции обмена ионами. Катиониты обменивают свои подвижные катионы 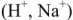 на катионы
на катионы 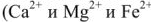 и др.). Аниониты обменивают анион
и др.). Аниониты обменивают анион 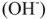 на анионы
на анионы 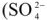 ,
, 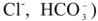 . К природным катионитам относятся алюмосиликаты (цеолиты, глины, пермутиты) общей формулы
. К природным катионитам относятся алюмосиликаты (цеолиты, глины, пермутиты) общей формулы 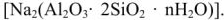 . К катионитам искусственного происхождения относятся сульфированные бурые угли (сульфоугли), катиониты КУ-1, КУ-2, СБС, КБ-4 и др. Состав катионитов условно можно изобразить
. К катионитам искусственного происхождения относятся сульфированные бурые угли (сульфоугли), катиониты КУ-1, КУ-2, СБС, КБ-4 и др. Состав катионитов условно можно изобразить 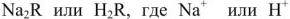 — подвижные катионы, a
— подвижные катионы, a 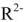 — анионы. Схематически катионный обмен можно изобразить уравнением:
— анионы. Схематически катионный обмен можно изобразить уравнением:
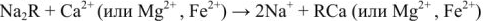
При этом ионы 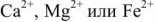 переходят из воды в катионит, а ионы
переходят из воды в катионит, а ионы 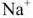 или
или 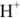 — из катионита в воду. После использования большей части катионов
— из катионита в воду. После использования большей части катионов 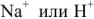 катионит регенерируют, выдерживая в растворе
катионит регенерируют, выдерживая в растворе 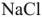 или
или 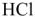 . При этом происходит обратный процесс.
. При этом происходит обратный процесс.

Регенерированный катионит может быть использован для умягчения новых порций воды.
Аниониты (АВ-16, АВ-17, АН-2Ф и др.). Функциональными группами анионитов являются аминогруппы 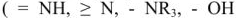 и др.). Они обменивают эти группы на анионы солей жесткости
и др.). Они обменивают эти группы на анионы солей жесткости 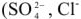 и др.):
и др.):
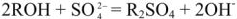
Анионит регенерируется раствором 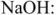
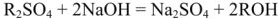
При ионировании обрабатываемую воду с определенной скоростью пропускают через слой ионита, находящийся в ионитовом фильтре. За время контакта воды с ионитом происходит обмен ионами. В момент истощения ионита наступает «проскок» ионов солей жесткости , что свидетельствует о необходимости регенерации ионита.
При использовании ионитов рассчитывают обменную емкость (е, ммоль/г или ммоль/см3), которая равна максимальному количеству миллимоль эквивалентов ионов солей жесткости 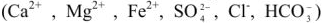 , поглощаемому 1 г или 1
, поглощаемому 1 г или 1 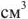 ионита.
ионита.
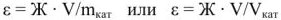
где 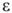 — обменная емкость ионита, ммоль/г или ммоль/
— обменная емкость ионита, ммоль/г или ммоль/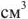 ; Ж — жесткость воды, ммоль/л; V — объем воды, л;
; Ж — жесткость воды, ммоль/л; V — объем воды, л; 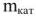 — масса ионита, г;
— масса ионита, г; 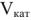 — объем ионита,
— объем ионита, 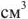 .
.
В современных катионитах высота слоя катионита составляет 2 — 4 м, а скорость фильтрования можно варьировать в широких пределах — от 4 до 60 м/ч.
Пропуская воду последовательно через катионит и анионит, можно полностью удалить из воды содержащиеся в ней электролиты.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Физические свойства в химии |
| Химические свойства воды в химии |
| Диаграмма состояния воды в химии |
| Топоскопический закон Рауля |

