Оглавление:
Металлы VIII группы
Задача 102.
Используя справочные значения изменений стандартных энергий Гиббса образования веществ, определить возможность самопроизвольного протекания реакции:
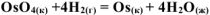 при стандартных условиях. Ответ мотивировать расчетом
при стандартных условиях. Ответ мотивировать расчетом 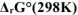 .
.

Решение:
Возможность самопроизвольного протекания реакции при 298К определяется знаком величины изменения энергии Гиббса для данной реакции: если 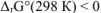 , самопроизвольное протекание реакции при заданных условиях возможно;
, самопроизвольное протекание реакции при заданных условиях возможно;
если 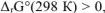 , то при заданной температуре реакция невозможна. .
, то при заданной температуре реакция невозможна. .
Значение 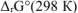 определяем по первому следствию из закона Гесса:
определяем по первому следствию из закона Гесса:
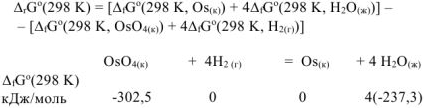
Тогда:
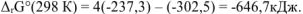
Ответ: так как 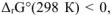 то самопроизвольное протекание реакции возможно.
то самопроизвольное протекание реакции возможно.
Задача 103.
Вычислить концентрацию ионов железа в 0,01 М растворе 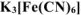 , содержащем, кроме того, 0,02 моль/л цианида калия. Константа нестойкости иона
, содержащем, кроме того, 0,02 моль/л цианида калия. Константа нестойкости иона 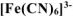 в водном растворе равна
в водном растворе равна 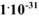 .
.

Решение:
Первичная диссоциация комплексных солей протекает по типу диссоциации сильных электролитов:
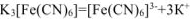
Концентрация комплексного иона 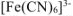 равна 0,01 моль/л, так как из одной молекулы комплексной соли образуется один комплексный ион.
равна 0,01 моль/л, так как из одной молекулы комплексной соли образуется один комплексный ион.
Константа нестойкости комплексного иона 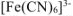 характеризует следующий равновесный процесс:
характеризует следующий равновесный процесс:
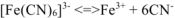 (вторичная диссоциация)
(вторичная диссоциация)
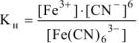
Присутствие цианида калия в растворе смещает равновесие диссоциации комплексного иона (17.2) влево вследствие возрастания концентрации одноименного иона 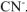 , образующегося при диссоциации
, образующегося при диссоциации 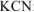 :
:
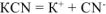
После смещения равновесия устанавливается новое равновесие. Концентрацию 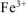 в новом равновесии принимаем равной х моль/л.
в новом равновесии принимаем равной х моль/л.
Общая равновесная концентрация 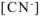 равна сумме концентраций
равна сумме концентраций 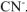 , образовавшихся при диссоциации
, образовавшихся при диссоциации 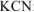 и
и 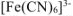 :
:
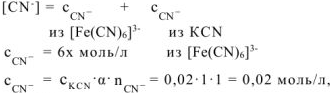
из 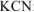
так как 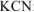 сильный электролит,
сильный электролит, 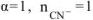 .
.
Тогда:
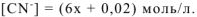
Вследствие малости x, принимаем: 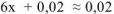 моль/л. Таким образом, выражение (17.3) примет вид:
моль/л. Таким образом, выражение (17.3) примет вид:
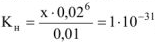
откуда 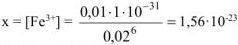 моль/л
моль/л
Ответ: 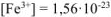 моль/л.
моль/л.
Задача 104.
Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей: а) сульфата кобальта (II), б) хлорида палладия (II) (анод инертный). Какие продукты выделяются на аноде и катоде.

Решение:
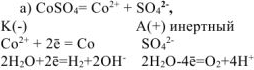
На катоде выделяется 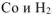 , на аноде выделяется
, на аноде выделяется 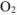 .
.

На катоде выделяется 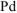 , на аноде выделяется
, на аноде выделяется 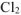 .
.
Задача 105.
Составить ионно-молекулярное молекулярное уравнения гидролиза хлорида железа (III). Вычислить константу, степень и pH гидролиза соли в 0,01М растворе.
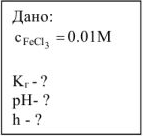
Решение:
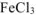 диссоциирует в растворе:
диссоциирует в растворе:
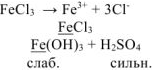
Сокращенное ионно-молекулярное уравнение гидролиза:
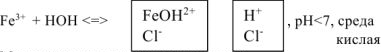
Молекулярное уравнение гидролиза:
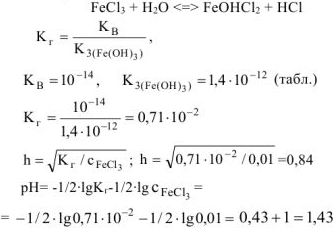
Ответ: 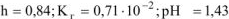
Задача 106.
Используя справочные данные по 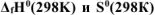 веществ определить равновесное парциальное давление
веществ определить равновесное парциальное давление 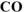 при температуре 1000 К для реакции:
при температуре 1000 К для реакции:
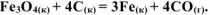

Решение:
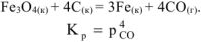
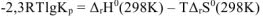
Значения 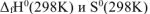 веществ берем из табл.
веществ берем из табл.
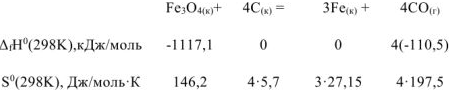

Ответ: 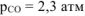 .
.
Задача 107.
При растворении 6 г сплава меди, железа и алюминия в хлороводородной кислоте выделилось 3 л водорода (н.у.) и получено 1,86 г нерастворившегося осадка (н.о.). Определить состав сплава (%мас.).

Решение:
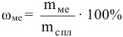
В хлороводородной кислоте растворяются железо и алюминий согласно следующим уравнениям реакций:
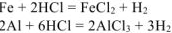
Медь в этих условиях не растворяется, следовательно:
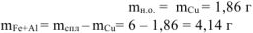
Пусть х — масса железа в сплаве, г;
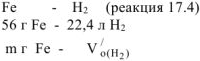
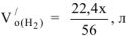
Тогда (4,14 — х) — масса алюминия в сплаве, г;

Суммарный объем выделившегося водорода:
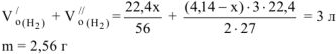
Следовательно 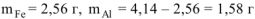
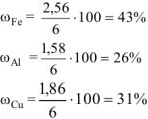
Ответ: состав сплава: 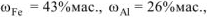 ,
,
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:
| Металлы V — VI группы задачи с решением |
| Металлы VII группы задачи с решением |
| Основные классы неорганических соединений задачи с решением |
| Эквивалент. Закон эквивалентов задачи с решением |

