Оглавление:
Криоскопический закон
Любое чистое вещество, находящееся в жидком состоянии, характеризуется определенной температурой замерзания, при которой оно полностью переходит в твердое состояние.
Раствор, в отличие от чистой жидкости, не превращается целиком в твердое вещество при одной температуре. Присутствие растворенного вещества понижает температуру замерзания растворителя.
Из раствора кристаллизуется только растворитель, вследствие этого концентрация раствора при вымораживании повышается. Это приводит к еще большему понижению температуры замерзания. Вследствие этого раствор кристаллизуется не при определенной температуре, а в некотором температурном интервале.
Температурой начала кристаллизации (температурой замерзания) раствора называется температура, при которой при охлаждении раствора начинает образование кристаллов. Из рис. 2 следует, что растворы кристаллизуются при более низкой температуре, чем чистый растворитель, причем, чем выше концентрация раствореннбого вещества (В), тем ниже температура замерзания раствора 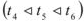 .
.
Разность между температурами замерзания чистого растворителя (для воды  = 0°С, рис. 4) и раствора (
= 0°С, рис. 4) и раствора ( рис. 4) называется понижением температуры замерзания раствора.
рис. 4) называется понижением температуры замерзания раствора.
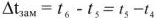
Для разбавленных растворов неэлектролитов понижение температуры замерзания пропорционально моляльности растворенного вещества в растворе
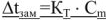
где:
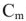 — моляльность растворенного вещества в растворе, моль/кг;
— моляльность растворенного вещества в растворе, моль/кг;
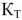 — криоскопическая постоянная.
— криоскопическая постоянная.
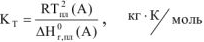
где:
R — газовая постоянная, R = 8,314, 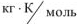 ;
;
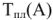 — абсолютная температура плавления чистого растворителя, К;
— абсолютная температура плавления чистого растворителя, К;
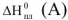 — энтальпия процесса плавления чистого растворителя, кДж.
— энтальпия процесса плавления чистого растворителя, кДж.
( Вода — 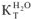 = 0,52; ацетон —
= 0,52; ацетон — 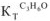 = 2,6; бензол —
= 2,6; бензол — 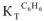 = 2,57; этиловый спирт —
= 2,57; этиловый спирт — 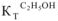 = 1,16).
= 1,16).
Пример
Вычислить температуру кипения и замерзания раствора, содержащего 0,1 моль сахарозы 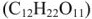 в 1000 г воды.
в 1000 г воды. 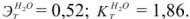
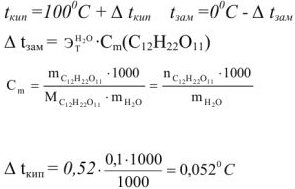
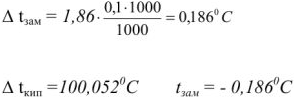
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Топоскопический закон Рауля |
| Эбуллиоскопический закон |
| Осмос в химии |
| Гальванический элемент в химии |

