Оглавление:






Краткие сведения о непредельных карбоновых кислотах
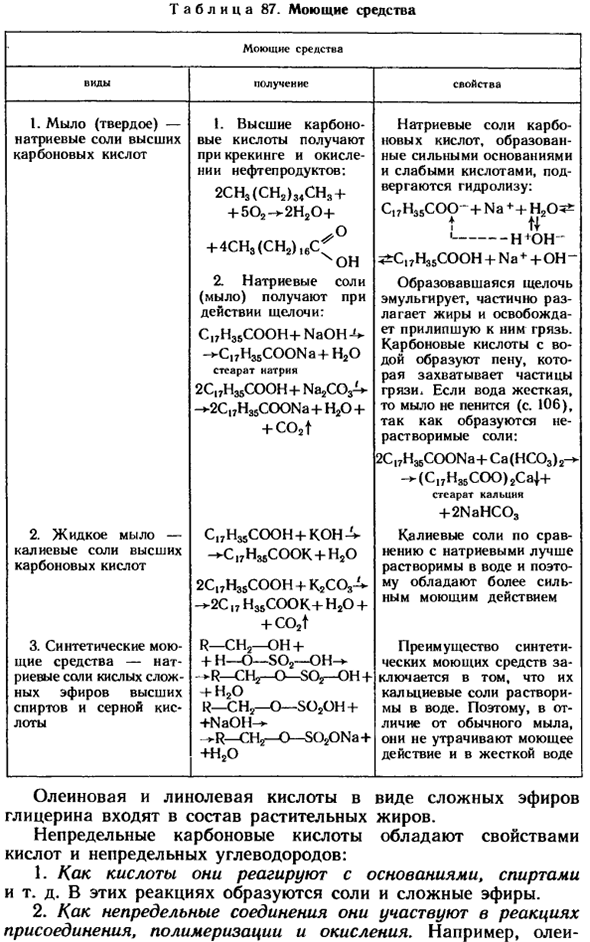
- Резюме ненасыщенных карбоновых кислот Вы можете перейти от формулы насыщенной карбоновой кислоты к формуле ненасыщенной кислоты точно так же, как формула ненасыщенного углеводорода получается из Формулы ненасыщенного углеводорода Таблица 87.Моющее средство Моющее средство Возьми Физические характеристики 1.
- Мыло (твердое) — натриевые соли высокосортных карбоновых кислот 2.Жидкое мыло-калийные соли высокосортных карбоновых кислот 3.Синтетическое моющее средство-натриевая соль высококачественного спирта и кислый эфир серной кислоты !
За счет разложения и окисления нефтепродуктов получают высшие карбоновые кислоты. Людмила Фирмаль
2CH3 (CH2) 34CH3 + + 502 — » — 2H20 + + 4CH3 (СН2) » 1С » (г Книги 2.Натриевая соль (мыло) получается под действием щелочи. C | 7H35COOH + NaOH ^ — ^ C. yH ^ COONa + HaO скорость звезды натрия ч. С. ООН Соон ^ + Na2C03-у- » — 2С, 7H35COONa + Н20 + + co2t C ^ H ^ COOH + KOH-V — ^ C. yHajCOOK + HjO 2C17H35COOH + K2COA — — 2С» Н ^ Кук-Ф Н20 + + co2t Р-СН2-он + + нет-ѕо2-ой-— — >Р-ЧГ-о-Сож-о + ч-Н2О Р-С Н2-о-SOjOH + + Nаон-> г-СН2-о-SOjXDNa + + H2O Гидролизу подвергаются натриевые соли карбоновых кислот, образованные сильными основаниями и слабыми кислотами.
C17H35COO — + Н Н20 ^ т и От — — — — монахини 3 ^ С ^ Н ^ Соон + Н♦+ О- Полученная щелочь эмульгирует жир, частично разлагает его и высвобождает прилипшую грязь. Вода и кислота на боку автомобиля образуют пузырьки, которые ограничивают частицы грязи. Если вода жесткая, то мыло не будет пениться, потому что образуются нерастворимые соли(с. 106). 2C » H ^ COONa + Ca(HC03)2— — *- (С, 7Н85СОО) 2СА / — + — калий Калий +2nahc03
По сравнению с натрием, соли калия лучше растворяются в воде, и поэтому обладают более сильным очищающим действием. Преимущество синтетических моющих средств заключается в том, что соли кальция растворяются в воде. Поэтому, в отличие от обычного мыла, оно не теряет своего очищающего эффекта в жесткой воде Олеиновая и линолевая кислоты в виде сложных эфиров глицерина входят в состав растительных жиров.
Ненасыщенные карбоновые кислоты обладают свойствами кислот и ненасыщенных углеводородов. 1.As кислоты, они реагируют с основаниями, спиртом, etc. In в результате этих реакций образуются соли и сложные эфиры. 2.As ненасыщенные соединения, они участвуют в реакциях присоединения, полимеризации и окисления. Например, Олей- Новая кислота обесцвечивает бромистую воду.
При взаимодействии с водородом он превращается в стеариновую кислоту. C17H33COOH + H2-jj C17H35COOH На этом свойстве основано производство твердых жиров из растительных масел. Способность ненасыщенных кислот окисляться используется при варке льняного масла и льняного масла, которые содержат олеиновую и линолевую кислоты в виде сложных эфиров.
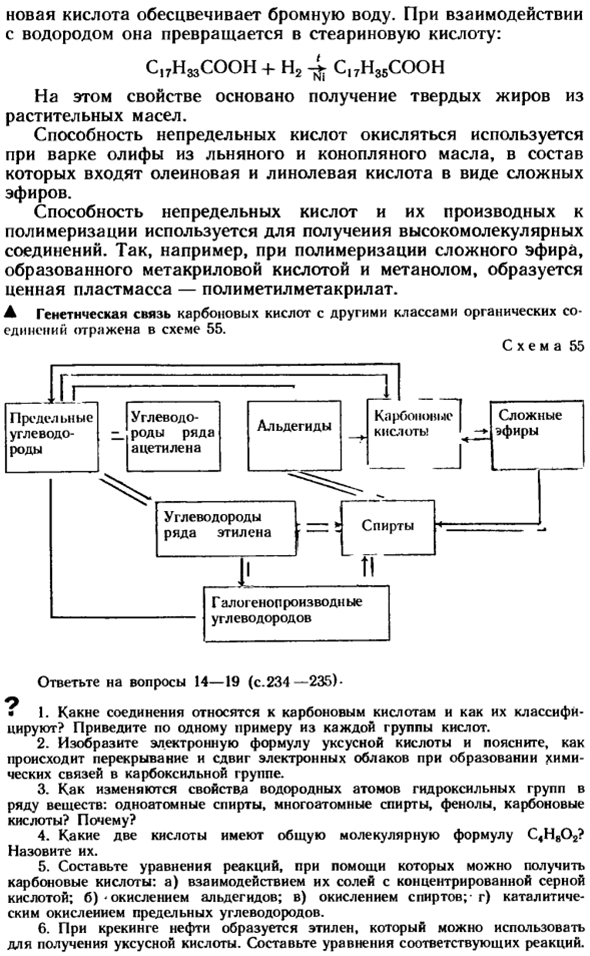
Полимеризационная способность ненасыщенных кислот и их производных используется в производстве высокомолекулярных соединений compounds. So например, при полимеризации сложных эфиров, образованных метакриловой кислотой и метанолом, образуется ценный пластик, то есть материал напольного покрытия и метилметакрилат. Генетическая связь между карбоновой кислотой и другими классами органических соединений отражена на схеме 55.
Образец 55 Вопрос 14-19 (стр. 234-235).- О * 1.Что такое карбоновые кислоты и как они классифицируются? Возьмем пример из каждой группы кислот. 2.Мы рисуем электронную формулу уксусной кислоты и объясняем, как электронное облако перекрывается и сдвигается при образовании химической связи карбоксильной группы. 3.Как изменяются свойства атома водорода гидроксильной группы многих веществ: одноатомных спиртов, многоатомных спиртов, фенолов, карбоновых кислот? Почему?
4.Что такое кислота с общей молекулярной формулой C4HbOa? Назвать их. 5.Создайте реакционную формулу для получения карбоновых кислот. а) взаимодействие соли и концентрированной серной кислоты. б) окисление альдегидов. в) окисление спирта; г) каталитическое окисление насыщенных углеводородов. 6.При разложении масла образуется этилен, который может быть использован для получения уксусной кислоты.
Создайте уравнение для соответствующей реакции. 7.Создайте уравнение реакции для получения уксусной кислоты. а) от метана. б) карбонат кальция и другие вещества, необходимые для этого процесса. 8.Карбоновые кислоты обладают свойствами, общими для всех кислот. Возьмем в качестве примера пропионовую кислоту и создадим подходящую формулу реакции в виде молекул, ионов и укороченных ионов.
9.Сдвиг электронной плотности показан на молекулярной диаграмме монохлоруксусной кислоты. В г Ди-о-с ’ Я Н. В Как можно объяснить это явление? Какая кислота-c1ch2-COOH или CH3-COOH-монохлоруксусная должна быть сильнее? Мотивирует ответ. 10.Почему из всех карбоновых кислот в качестве восстановителя можно использовать только муравьиную кислоту?
11.Когда серную кислоту наносят на раствор обычного мыла, на поверхность поднимаются твердые вещества, которые не растворяются в воде. Составьте уравнение для реакции и назовите это вещество. 12.При стирке одежды жесткой водой расход мыла значительно увеличивается. Как это можно объяснить? Объясните ответ в уравнении реакции.
13.Каков состав и преимущества синтетических моющих средств по сравнению с обычным мылом? 14.Напишите уравнение реакции между метакриловой кислотой и метанолом. 15.Is возможна ли цис-и транс-изомеризация ненасыщенных кислот? Рассмотрим это в ненасыщенных кислотах, молекулярная формула которых C | 7H3CCOOH, и построим молекулярную структуру этих изомеров.
16.Be обязательно опишите каждое из веществ, в которых химическая формула указана ниже. б)изомеры. Напишите имя под формулой: СН3—СНа-ССН3СН2-СН2-СН2-С Н ^его CH3-CH2-OH CH3-CH2-(G CH3-0-CH3 | X) N sn3 СН3-с ^ ХГ-проблемы с snone-sn3 ^ Н СN, — ву2-с ^ cn3 для — ву2 — cn3 для cn2on-о-ву2—СН, он 17.Создайте уравнение реакции, которое может выполнять следующие преобразования: а)CH » — C2H2-CH3-SG CH3-CH2-OH CH3-CH2-Br QH < XN * СН3-СН2-ОН СН3-С ^ — СН3-С ^ СН3-С ^ 4и з)ч 4ONa б)СН4-Н-С^^-СНз-ОНСН3〜С1-QH6 -? — C, N » Ohснз сгсн-Сгсн4 4.
18.In в соответствии со схемой 55, для создания соответствующего уравнения химической реакции используют материал для генетического связывания. 19.Составьте сводку ответов, характеризующих муравьиную кислоту, уксусную кислоту, стеариновую кислоту(I, стр. 43). № 1.При анализе вещества было установлено, что оно содержит 0,4. d. углерод 40%, или 0.0666 5 месяцев. d. или 6,66%, водород и 0,5334 d. или 53,34% кислорода.
Если вы знаете, что плотность пара в воздухе равна 2,07, найдите молекулярную формулу и назовите это вещество. 2. 112 литров ацетилена (n. a. сколько веса уксусной кислоты я могу получить от a)? 3. Рассчитайте количество граммов раствора, содержащего 5 месяцев 0,7 дня. d. или 70%муравьиная кислота необходима для нейтрализации 0,1 кг раствора, содержащего 2. d. или 10% гидроксид натрия.
Какая будет соль и сколько? 4.Если выход составляет 5 месяцев 0,9 дня, то количество метана, необходимое для синтеза 30 тонн муравьиной кислоты. d. или 90% (n. a.)? 5. 5 какая соль и сколько ее будет при нейтрализации 0,1 г раствора, содержащего 112 дней. d. вы использовали гидроксид калия или Noos-COOH с 18G щавелевой кислотой?
Лабораторные опыты Взаимодействие стеариновой и олеиновой кислот со щелочью. 1. 1 положите небольшое количество стеариновой кислоты в одну пробирку и налейте 2 мл олеиновой кислоты в другую пробирку. Добавьте 2-3 мл дистиллированной воды в обе пробирки и встряхните. Кислоты не растворяются в воде. 2.
- Через 5 месяцев к кислоте добавляют 0,2 мл раствора, содержащего 2-3 мл. d. прогрейте, встряхнув смесь, или 20% гидроксид натрия. Обе кислоты растворяются в присутствии гидроксида натрия. Несколько растворов, полученных в последнем эксперименте, разливают в 2 пробирки, добавляют 2-3 мл дистиллированной воды и встряхивают.
4.Добавьте 1-2 мл известковой воды к полученному раствору пены и встряхните его. Задача. Почему растворы этих веществ в дистиллированной воде образуют пузырьки, а гидроксид кальция-нерастворимые хлопья-присутствует?
Какие вещества образуются при взаимодействии стеариновой кислоты с олеиновой кислотой и гидроксидом натрия? Людмила Фирмаль
Создайте уравнение для соответствующей реакции. Соотношение брома воды и раствора перманганата калия к олеиновой кислоте. Налейте 1-2 мл олеиновой кислоты в 2 пробирки. В 1 пробирку добавляют 1-2 мл бромной воды, а в другой пробирке разбавляют тем же перманганатом калия. Встряхните обе трубки. Задача.
Почему происходит отбеливание, когда олеиновая кислота вступает в реакцию с раствором брома, воды и перманганата? Напишите уравнение реакции брома и олеиновой кислоты. Сравнение свойств мыла и синтетического моющего средства. 1. Приготовьте 3 колбы разбавленного раствора по 50 мл. b) 1 синтетического стирального порошка. c) 1 синтетического жидкого моющего средства.
В пробирку наливают 2-3 мл приготовленного раствора и добавляют в него несколько капель раствора фенолфталеина. Если моющее средство предназначено для стирки хлопчатобумажных тканей, то реакция щелочная, а для шелковых и шерстяных тканей-нейтральная. Поэтому цвет индикатора в растворе синтетических моющих средств различается по-разному. 2. Налейте от 24 до 5 мл молока с ионами CA и Mg2 в 3 пробирки.
При встряхивании капните мыльный раствор в первую пробирку и опустите его в предварительно подготовленный 2-й и 3-й растворы синтетического моющего средства. Задача. 1.Почему мыльный раствор вызывает щелочную реакцию? Объясните ответ в уравнении реакции. 2.Вот моющие средства, используемые для стирки: а) хлопчатобумажная ткань.
б)шелк и шерсть в жесткой воде? На основании этих экспериментов мы делаем выводы о преимуществах некоторых моющих средств. изучение свойств зубного налета и канала углекислоты с использованием около 6 и я в К и Я. Получить уксусную кислоту. В пробирку помещают 2-3 г ацетата натрия и добавляют 1,5-2 мл концентрированной серной кислоты. Закройте трубку газовой трубкой.
Край газовой трубки опускается на другую трубку (рис.159). Нагрейте смесь с пламенем до тех пор, пока 1,0-1,5 мл жидкости не соберется в трубке приемника. Задача. Что такое вещество, образованное в теге приемника? Каковы признаки, которые подтверждают это? Составьте уравнение реакции. Взаимодействие уксусной кислоты с некоторыми металлами. Налейте 1 раствор уксусной кислоты в 2 пробирки.
Налейте немного магниевых чипсов в 1 пробирку и налейте немного цинковых гранул во 2-ю tube. In в первой пробирке идет бурная реакция, во второй пробирке реакция протекает мягко(иногда она начинается только при нагревании). Задача. Как уксусная кислота реагирует с магнием или цинком? Сравните скорость этих реакций и напишите уравнения в виде молекул, ионов и укороченных ионов. Взаимодействие оснований с уксусной кислотой.
Налейте от 4 до 1,5 мл раствора гидроксида натрия в пробирку и добавьте несколько капель раствора фенолфталеина. Если добавить CH3COOH, произойдет обесцвечивание. Взаимодействие уксусной кислоты и спирта. I. налейте 2 мл раствора уксусной кислоты в 2 пробирки. Залейте 1 из них 2 мл этанола, а еще 1 2 мл изопентилового спирта.
Затем осторожно добавьте 1 мл концентрированной серной кислоты в обе пробирки. Закройте пробку пробкой с длинной стеклянной охлажденной трубкой. Медленно прогрейте смесь. 2.Перелейте жидкость из каждой пробирки в 2 емкости, содержащие насыщенный раствор хлорида натрия. Задача. 1.Свойства уксусной кислоты аналогичны свойствам минеральных кислот?
2.Какие вещества образуются при взаимодействии уксусной кислоты с основанием? Какие эксперименты могут это доказать? 3.Какие вещества образуются при взаимодействии уксусной кислоты и спирта? Напишите уравнение соответствующей реакции. Окисление муравьиной кислоты оксидом серебра (I). 5.вновь приготовленный раствор, содержащий 0.02 мин.
2 мл наливают в чистую пробирку. d. или 2%.Растворяют осадок с добавлением нитрата серебра (I), небольшого количества разбавленного раствора аммиака. Далее добавляют несколько капель муравьиной кислоты и нагревают пробирку со смесью в колбе с горячей водой. Задача.
Почему реакция серебряного зеркала характерна для муравьиной кислоты, а другие карбоновые кислоты не обладают этим свойством? Напишите уравнение соответствующей реакции. Практика 2 Решение экспериментальных задач. 1.Следующие вещества помещают в 3 пробирки. б)бензол; в) раствор уксусной кислоты. Определите каждое вещество. 2.
Мы раздали 4 трубки. а) не содержит глицерина. б)использования этилового спирта. в) использование раствора фенолата натрия. д)использование формалина. Определите пробирку, содержащую каждое вещество. В пробирку наливают 3,2 мл этанола, добавляют в нее 2 мл разбавленного раствора перманганата калия, добавляют несколько капель серной кислоты. Нагрейте смесь. Почему изменился цвет раствора?
4.Поместите следующие карбоновые кислоты в 3 пробирки. муравьиная кислота. б) уксус; в) олеиновая кислота. Как отличить эти вещества? Рисунок 159.Получение уксусной кислоты. 5.Пластичные образцы будут обеспечены. полиэтилен. б) поливинилхлорид. Определите каждый из этих пластиков эмпирически. Опишите критерии, которые вы определяете. 6.Выполните собственно реакцию по следующей схеме. а)CaQC02 б)QHsOH + C ^ — C ^bra c)СН3-СН, — он—► ► — д)ч-Ср ^ — Н-С ^ ЧНЧ)Н
Смотрите также:
| Карбоновые кислоты | Сложные эфиры |
| Одноосновные предельные карбоновые кислоты | Жиры |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.

