Оглавление:
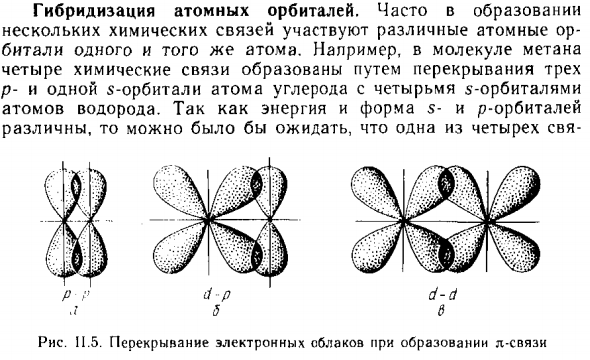

Гибридизация атомных орбиталей
- Гибридные атомные орбитали. Часто в образовании Различные атомы или Ударь тот же атом. Например, молекула метана 4 химические связи образуются путем перекрытия 3 P атома углерода с четырьмя пятью орбиталями и одной пятью орбитали Атом водорода. Из энергии и формы 5 орбит и р орбиты Разные. Один из четырех R g s! Rns. 11,6.
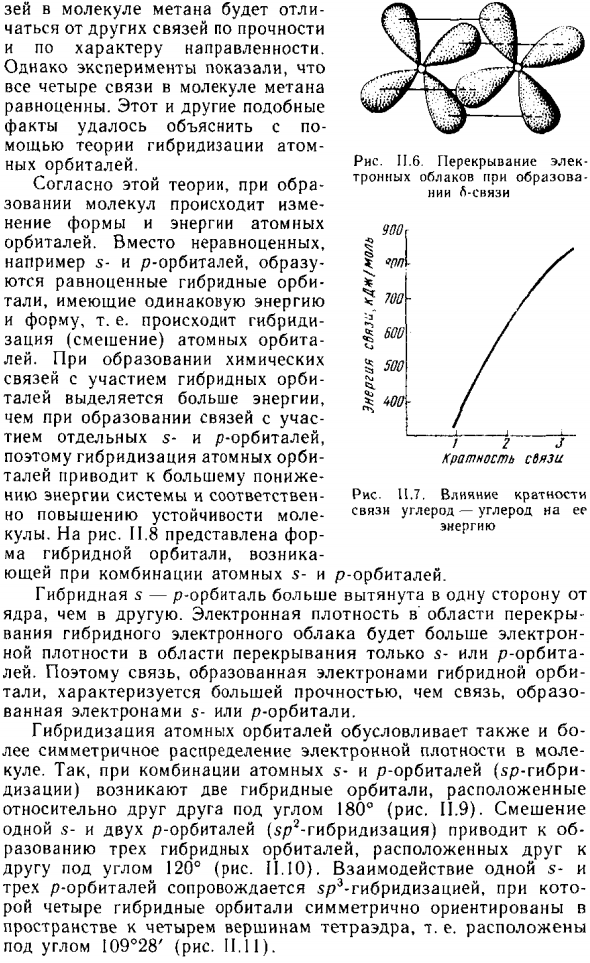
- Дубликат Электронное облако при образовании L-Communication Laboratory 900 Я § 700 & 600 55 » Я ^ J ^ 00. Зее молекулы метана Расслабьте другие силы связи Характер ориентации. Однако экспериментом Все четыре связи молекулы метана Это эквивалентно. Этот и другие похожие Факт Сила атомно-гибридной теории нью орбита.
Согласно этой теории, Молекулы Форма и атомная энергия Orbit. Людмила Фирмаль
Вместо разных вещей ,Например, 5 орбит и p орбит, изображения Эквивалентная гибридная орбита Подъемник с такой же энергией И форма, то есть гибрид, будет происходить Атомно-орбитальное состояние (смешанное) Рей. В образовании химических веществ Гибридная сфера Подъемник высвобождает больше энергии Чем формирование отношений с 5 отдельных орбит и р-орбиталей.
Следовательно, гибрид атомных орбиталей Подъемник ведет к большей нижней части Энергия системы и, следовательно, Но увеличить стабильность моль Класс. Рисунок 8 представлен MA гибридная генерация орбиты Это связано с комбинацией атомных орбиталей 5 и p орбиталей. Гибридная 5-р орбита дополнительно вытянута в одном направлении Ядро, чем другие.
- Перекрытая плотность электронов Облако гибридных электронов становится больше электронов. Плотность области перекрытия составляет 5 или только орбитальная Рей. Следовательно, связи, образованные гибридными орбитальными электронами Подъемник. Комбинированный, характеризуется большей интенсивностью, чем изображение Электронный автобус 5 или р орбита.
Также определяет гибрид атомных орбиталей Более симметричное распределение электронной плотности в моле Кура. Есть две гибридные орбиты Они расположены напротив друг друга под углом 180 ° (рис. A.9). неразбериха Одна 5 и 2 р-орбитали (5р ^ гибридизация).
Следовательно, сочетание атома 5 и орбитали р (хр гибридное dizations). Людмила Фирмаль
Развитие трех гибридных орбит, расположенных друг на друге Другу под углом 120 ° (рис. А.10). 1 5 взаимодействий Три p-орбитали сопровождаются 5p-гибридизацией. Группа из четырех гибридных орбит Пространство для четырех вершин тетраэдра, то есть Под углом 109 ^ 28 ‘(рис. 11.11).
Смотрите также:
| Донорно-акцепторный механизм образования ковалентной связи | Пространственная конфигурация молекул |
| Ϭ-, π- и ẟ-Связи | Полярные и неполярные молекулы |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.

