Факторы, влияющие на направленность химических процессов
В соответствии с уравнением 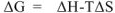 знак и величина изменения свободной энергии Гиббса, а, следовательно, и направление протекания химической реакции, определяются знаком и величиной изменения энтальпийного фактора
знак и величина изменения свободной энергии Гиббса, а, следовательно, и направление протекания химической реакции, определяются знаком и величиной изменения энтальпийного фактора 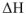 и энтропийного фактора
и энтропийного фактора 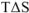 .
.
Влияние энтальпийного и энтропийного факторов на направленность химических процессов.
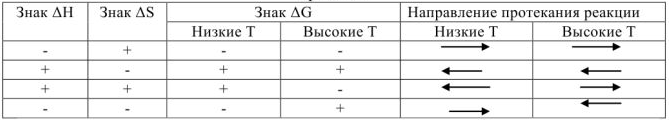
На основании приведенной таблицы можно сделать следующие выводы:
1. Если реакция экзотермическая, 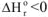 и протекает с увеличением энтропии
и протекает с увеличением энтропии 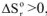 , то
, то 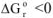 при всех температурах, и реакция может самопроизвольно протекать при любых температурах, в том числе и при низких, например:
при всех температурах, и реакция может самопроизвольно протекать при любых температурах, в том числе и при низких, например: 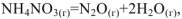 ,
, 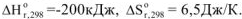
2. Если реакция эндотермическая, 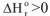 и протекает с уменьшением энтропии
и протекает с уменьшением энтропии 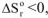 ,
, 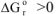 при всех температурах. Такая реакция невозможна при любых температурах, например:
при всех температурах. Такая реакция невозможна при любых температурах, например: 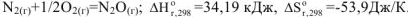
3. Если реакция эндотермическая 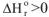 и протекает с увеличением энтропии
и протекает с увеличением энтропии 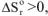 , то величина и знак изменения энергии Гиббса будут определяться соотношением абсолютных значений энтальпийного и энтропийного факторов:
, то величина и знак изменения энергии Гиббса будут определяться соотношением абсолютных значений энтальпийного и энтропийного факторов:
3.1. При низких температурах, когда 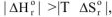 следовательно
следовательно 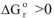 протекание реакции невозможно;
протекание реакции невозможно;
3.2. При высоких температурах, когда 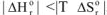 , следовательно
, следовательно 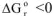 протекание реакции возможно;
протекание реакции возможно;
3.3. При температуре, когда 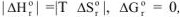 . и система находится в равновесии, например:
. и система находится в равновесии, например: 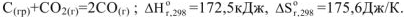
Таким образом, эндотермические реакции протекают только при высоких температурах за счет энтропийного фактора, т.е. за счет стремления системы к увеличению беспорядка.
4. Если реакция экзотермическая 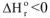 и протекает с уменьшением энтропии
и протекает с уменьшением энтропии 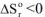 то величина и знак изменения энергии Гиббса также будут определяться соотношением абсолютных значений энтальпийного и энтропийного факторов:
то величина и знак изменения энергии Гиббса также будут определяться соотношением абсолютных значений энтальпийного и энтропийного факторов:
4.1. При низких температурах, когда  следовательно
следовательно 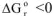 , протекание реакции возможно;
, протекание реакции возможно;
4.2. При высоких температурах, когда 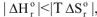 ,
, 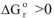 и протекание реакции невозможно.
и протекание реакции невозможно.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:

