Оглавление:
Энергетика химических реакций
Задача 20.
Рассчитать изменение стандартных энтальпии и энтропии химической реакции:
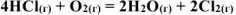

Решение:
Изменение стандартных энтальпии и энтропии химической реакции рассчитываем на основании первого следствия из закона Гесса:
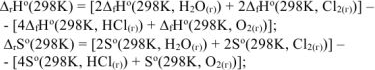
где 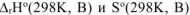 — стандартные энтальпии образования и энтропии веществ, которые находим из таблицы
— стандартные энтальпии образования и энтропии веществ, которые находим из таблицы
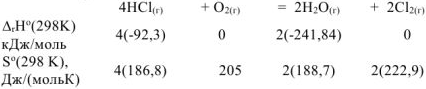
тогда:
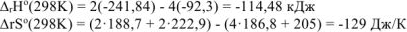
Ответ: 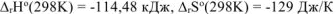
Задача 21.
Стандартная энтальпия реакции сгорания метанола  равна (-726,64) кДж/моль. Написать термохимическое уравнение сгорания метанола и вычислить стандартную энтальпию его образования.
равна (-726,64) кДж/моль. Написать термохимическое уравнение сгорания метанола и вычислить стандартную энтальпию его образования.
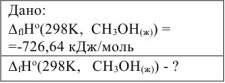
Решение:
Стандартной энтальпией сгорания вещества 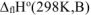 называется тепловой эффект реакции полного сгорания 1 моль органического вещества до
называется тепловой эффект реакции полного сгорания 1 моль органического вещества до 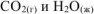 при стандартных условиях.
при стандартных условиях.
Составляем термохимическое уравнение сгорания 1 моль метанола:
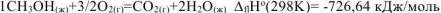
Следовательно, для данной реакции 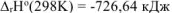
Для определения 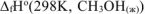 используем первое следствие из закона Гесса для этой же реакции:
используем первое следствие из закона Гесса для этой же реакции:
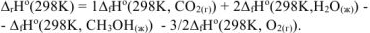
Откуда: 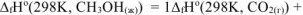
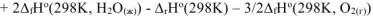
Значения стандартных энтальпий образования 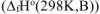 веществ берем из таблицы стандартных термодинамических величин.
веществ берем из таблицы стандартных термодинамических величин.
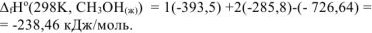
Ответ: 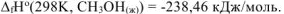 .
.
Задача 22.
Вычислить стандартную энтальпию растворения 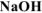 в воде, если при растворении 10 г
в воде, если при растворении 10 г 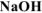 в 250 мл воды температура раствора повысилась от
в 250 мл воды температура раствора повысилась от 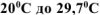 . Удельная теплоемкость раствора равна 3,99 Дж/(г*К).
. Удельная теплоемкость раствора равна 3,99 Дж/(г*К).

Решение:
Стандартную энтальпию растворения рассчитываем по уравнению:
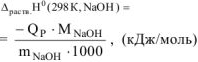
где 
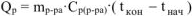 , -количество выделившейся теплоты при растворении 10 г
, -количество выделившейся теплоты при растворении 10 г 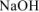 , Дж
, Дж
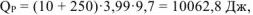
где 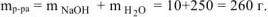
Для рассматриваемой задачи 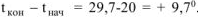 . При этом следует учесть, что знак «+» указывает на повышение температуры при растворении, а знак — на понижение температуры.
. При этом следует учесть, что знак «+» указывает на повышение температуры при растворении, а знак — на понижение температуры.
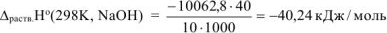
1000 — пересчет Дж в кДж.
Ответ: 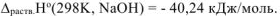
Задача 23.
Найти массу метана 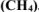 , при полном сгорании которого до
, при полном сгорании которого до 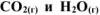 в тепловом агрегате выделяется теплота, достаточная для нагревания 1 л воды от 20 до 100°С. Мольную теплоемкость воды принять равной 75,3 Дж/моль*К. КПД теплового агрегата составляет 50%.
в тепловом агрегате выделяется теплота, достаточная для нагревания 1 л воды от 20 до 100°С. Мольную теплоемкость воды принять равной 75,3 Дж/моль*К. КПД теплового агрегата составляет 50%.

Решение:
Количество теплоты, необходимое для нагревания 1 л (1000 г) воды от 20 до 100°С определяем по формуле:
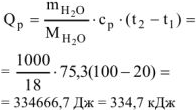
Определим массу метана при горении, которого выделяется такое количество теплоты. Процесс горения метана по условию задачи описывается уравнением:
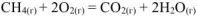
Тепловой эффект этой реакции 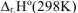 определяем по I следствию из закона Гесса
определяем по I следствию из закона Гесса
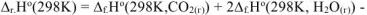
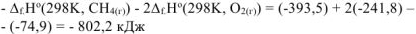
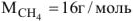
Таким образом при сгорании 16 г метана выделяется 802,2 кДж тепла. Определяем массу метана, при сгорании которой выделяется 334,7 кДж теплоты. Составляем пропорцию:

С учетом КПД теплового агрегата масса метана составляет
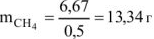
Ответ: масса метана составляет 13,34 г.
Задача 24.
Используя справочные данные по 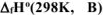 , определить при каких температурных условиях возможно самопроизвольное протекание реакции
, определить при каких температурных условиях возможно самопроизвольное протекание реакции
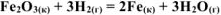

Решение:
Возможность самопроизвольного протекания реакции, определяется знаком перед величиной изменения энергии Гиббса для данной реакции:
если 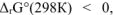 самопроизвольное протекание реакции при стандартных условиях возможно в прямом направлении;
самопроизвольное протекание реакции при стандартных условиях возможно в прямом направлении;
если 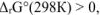 то при стандартных условиях прямая реакция невозможна, а возможна обратная реакция.
то при стандартных условиях прямая реакция невозможна, а возможна обратная реакция.
Значение 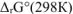 рассчитываем по формуле:
рассчитываем по формуле:
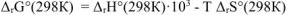
где 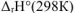 — изменение стандартной энтальпии реакции, кДж:
— изменение стандартной энтальпии реакции, кДж: 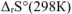 — изменение стандартной энтропии реакции, Дж/К:
— изменение стандартной энтропии реакции, Дж/К:
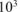 — пересчет кДж в Дж.
— пересчет кДж в Дж.
Значение 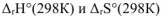 определяем согласно первому следствию из закона Гесса:
определяем согласно первому следствию из закона Гесса:
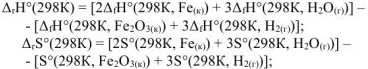
где 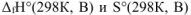 — стандартные энтальпии образования и энтропии веществ, значения которых находим из таблицы стандартных термодинамических величин.
— стандартные энтальпии образования и энтропии веществ, значения которых находим из таблицы стандартных термодинамических величин.

тогда:
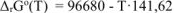
Ответ: При высоких температурах значение 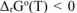 и, следовательно, реакция возможна при нагреве.
и, следовательно, реакция возможна при нагреве.
Задача 25.
Рассчитать теплотворную способность каменного угля, если известно, что в нем содержится 80% углерода, а в отходящих газах после сгорания угля содержится 14% 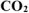 и 2%
и 2% 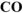 по объему.
по объему.

Решение:
Теплотворной способностью топлива называется тепловой эффект, который соответствует сгоранию единицы массы (1 кг) Для твердых и жидких видов топлив 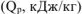
Приводим уравнения горения углерода
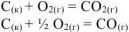
Из приведенных уравнений (ур. 4.8 и 4.9) следует, что масса сгоревшего углерода пропорционально объемам образовавшихся газов. Поскольку в каменном угле содержится 80% углерода, то в 1000 г каменного угля содержится 800 г углерода и в 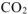 превратилось (ур 4.8)
превратилось (ур 4.8)
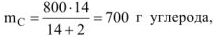
а в 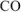 превратилось:
превратилось:  г углерода (ур. 4.8) Исходя из того, что тепловые эффекты реакций (4.8) и (4.9) есть стандартные энтальпии образования
г углерода (ур. 4.8) Исходя из того, что тепловые эффекты реакций (4.8) и (4.9) есть стандартные энтальпии образования 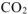 и
и 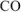 (величины табличные), но взятые с противоположным знаком, поскольку
(величины табличные), но взятые с противоположным знаком, поскольку
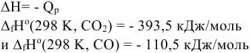
рассчитываем количество теплоты, выделившейся при сгорании 700 г углерода до 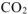 (ур. 4.8). Молярная масса углерода
(ур. 4.8). Молярная масса углерода 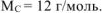
При сгорании
12 г углерода выделяется 393,5 кДж
700 г углерода выделяется 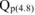 кДж
кДж
откуда:
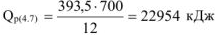
Рассчитываем количество теплоты, выделившейся при сгорании 100 г углерода до 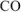 (ур.4.9).
(ур.4.9).
при сгорании
12 г углерода выделяется 110,5 кДж
100 г углерода выделяется 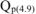 кДж
кДж
откуда:
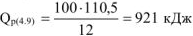
Следовательно теплотворная способность каменного угля
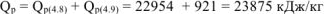
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:

