Диаграмма состояния
Вода может существовать в трех агрегатных состояниях (парообразном, жидком и шести кристаллических), каждое из которых устойчиво в определенных интервалах температуры и давления. Такие системы, т.е. представленные одним веществом, находящимся в различных агрегатных состояниях, называются однокомпонентными.
Переменными параметрами однокомпонентных систем служат только давление и температура. Графически состояние таких систем может быть представлено в виде зависимости давления от температуры 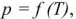 которая называется фазовой диаграммой состояния.
которая называется фазовой диаграммой состояния.
К фазовым диаграммам относятся:
- сублимация чистых кристаллических веществ:
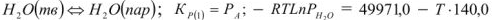
- испарение чистых жидкостей:
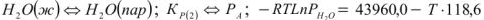
- плавление кристаллических веществ:
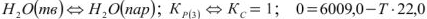
Уравнение (3) получается вычитанием уравнения (2) из уравнения (I).
Давление пара в процесса сублимации и испарения экспоненциально зависит от температуры:
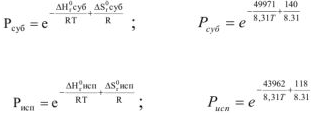
Точка плавления кристаллической фазы находится совместным решением уравнений (4) и (5), исходя, из условия равенства жидкой и кристаллической фаз при температуре плавления должно выполняться условие 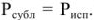 . В результате для точки плавления имеем:
. В результате для точки плавления имеем:
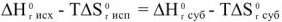
откуда 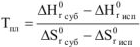
При процессе сублимации степень разупорядоченности движения частиц больше, чем при процессе испарения (в жидкости беспорядочность движения частиц больше, чем в кристаллах), поэтому

Поскольку температура может принимать только положительные значения, то величина
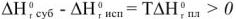
Уравнения (9) и (10) называются характеристиками плавления. Отсюда точка плавления определяется из соотношения:
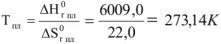
Зависимость температуры плавления чистых веществ от давления определяется уравнением Клаузиусса-Клайперона:
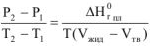
В данном уравнении 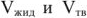 являются объемами 1 моль соединения в расплавленном и кристаллическом состояниях соответственно.
являются объемами 1 моль соединения в расплавленном и кристаллическом состояниях соответственно.
Если 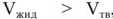 то правая часть уравнения (9) положительна, что соответствует положительному наклону линии
то правая часть уравнения (9) положительна, что соответствует положительному наклону линии 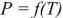 на рис. 1.
на рис. 1.
Если 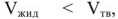 то правая часть уравнения (9) отрицательная, что соответствует отрицательному наклону линии
то правая часть уравнения (9) отрицательная, что соответствует отрицательному наклону линии 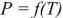 на рис. 1.
на рис. 1.
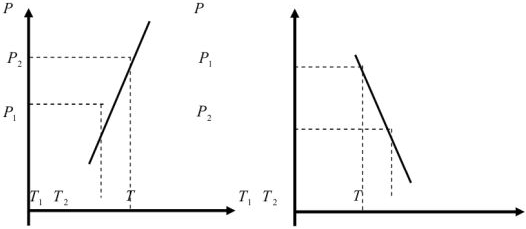
Рис. 1. Изменение характера наклона линии зависимости  при различных соотношениях удельных объемов вещества в твердом и жидком состояниях:
при различных соотношениях удельных объемов вещества в твердом и жидком состояниях:
Рассмотрим однокомпонентную систему жидкость-лед-пар. Согласно правила фаз Гиббса имеем: С + Ф = К + 2 = 3
где: С — степень свободы, показывает количество термодинамических параметров которые можно изменить и при этом система останется в заданном состоянии равновесия;
К — количество независимых компонентов системы:
Ф — количество фаз в системе.
Следовательно, эта система максимально может быть трехфазной (Ф=3) при числе степеней свободы, равном нулю (С=0), т.е. она не имеет ни одной степени свободы. Только при одном сочетании значений температуры и давление (0,61 кПа и 273,16 К) одновременно возможно существование трех фаз (лед, жидкость, пар) — данная точка называется тройной точкой. В данной точке согласно правила фаз Гиббса число степеней свободы равна нулю.
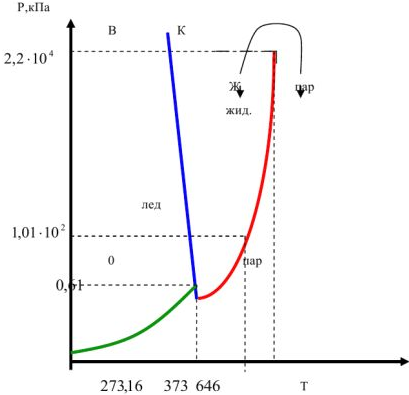
Рис. 2. Диаграмма состояния воды
Кривая ОА показывает равновесные условия между льдом и паром и характеризует зависимость давления насыщенного пара льда от температуры. Кривая ОВ отвечает равновесным условиям между льдом и жидкостью и представляет зависимость температуры замерзания воды от давления. Кривая ОК изображает равновесие между жидкостью и паром и представляет зависимость давления насыщенного пара жидкой воды от температуры.
Точка К — является критической точкой воды. Выше температуры 646 К вода при давлении больше 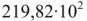 кПа не может находится в жидком состоянии. Выше данной температуры ни при каком давлении не происходит разделения на газообразную и жидкую фазы. В областях, лежащих за пределами кривой давления насыщенного пара и критической точки можно осуществить непрерывный переход жидкости в пар и пара в жидкость
кПа не может находится в жидком состоянии. Выше данной температуры ни при каком давлении не происходит разделения на газообразную и жидкую фазы. В областях, лежащих за пределами кривой давления насыщенного пара и критической точки можно осуществить непрерывный переход жидкости в пар и пара в жидкость  .
.
Обращает на себя внимание, что линия ОВ имеет отрицательный наклон, соответствующий отрицательному значению, так как 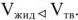 . Крутой ход кривых в равновесии между двумя конденсированными фазами объясняется незначительной разностью
. Крутой ход кривых в равновесии между двумя конденсированными фазами объясняется незначительной разностью 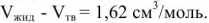 .
.
Следовательно, при замерзании воды ее объем увеличивается, что объясняется содержанием в кристаллической структуре льда большого количества пустот. При плавлении льда эта структура разрушается, и пустоты заполняются молекулами жидкой воды, в результате чего ее объем уменьшается. Кроме воды такой аналогией обладают висмут, галлий, оксид бора. Все остальные вещества имеют положительный наклон линии ОВ.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Химические свойства воды в химии |
| Методы умягчения воды в химии |
| Топоскопический закон Рауля |
| Эбуллиоскопический закон |

