Оглавление:





Свойства водорода
- Свойства водорода Физические свойства водород-это бесцветный, самый легкий газ. В 14,5 раза легче Рис.34.Восстановление меди водородом из оксида меди (II). Так как это воздух(1 литр, вес которого составляет 0,09 г), то мыльный пузырь, наполненный водородом, поднимается вверх.
- Растворимость водорода в воде очень мала, а температура сжижения очень низкая (-252,8°C). Химическое свойство. 1.Водород соединяется с кислородом. Если поджечь поток водорода(после проверки чистоты см. ниже), а трубку, в которой горит водород, опустить в емкость с кислородом, то на стенке емкости образуется капля воды. 2Ч,+ 02 2Ч20 Водород, кислород, вода.
Водород без примесей будет гореть спокойно. Людмила Фирмаль
Но смесь водорода и кислорода или воздуха взорвется. Наиболее взрывоопасной смесью, состоящей из 2 объемов водорода и 1 объема кислорода, является взрывоопасный газ. Если в стеклянном контейнере происходит взрыв, его осколки могут повредить другие. Поэтому, прежде чем поджигать водород, необходимо проверить его purity.
To сделайте это, соберите водород в пробирку, переверните ее вверх дном и верните в пламя. Если водород чистый, то он спокойно выгорит с характерным звуком «п-пах».Если водород содержит смесь воздуха, он будет гореть с помощью explosion. In во всех отраслях промышленности, где возможно образование смеси водорода и воздуха, необходимо соблюдать правила техники безопасности.
2.Характерным химическим свойством водорода является способность вступать в реакцию с оксидами определенных металлов. metals. So например, если при нагревании поток водорода проходит через оксид меди (II) (рис. 34), то происходит реакция, в результате которой образуются вода и металлическая медь: H2 + Cu0 — * H20 + Cu эта реакция противоположна реакции окисления, так как водород забирает кислород из атома меди.
Реакция, в которой кислород берется из соединения, связана с реакцией восстановления, а вещества, лишающие его кислорода, называются восстановителями. Процессы окисления и восстановления взаимосвязаны(один элемент окисляется, другой восстанавливается, и наоборот). ^ 3.Водород также связывается с другими неметаллами и некоторыми активными металлами.
Это может быть подтверждено, если водород из газоотводной трубки воспламеняется и погружается в хлорсодержащий цилиндр. Водород в атмосфере хлора будет продолжать гореть (рис. 35).Желтоватый цвет хлора постепенно обесцвечивается, потому что образуется бесцветный газ-хлористый водород: Ч,+ ДИ — * 2HCI Хлористый водород В воде с образованием соляной кислоты Хлористый водород хорошо растворяется в ЛПУ.
Если вылить струю водорода в пробирку с кипящей серой, то она будет пахнуть тухлыми яйцами. Это запах сероводородного газа H2S. Рис.35.Сжигание водорода в атмосфере хлора. м.:■■: У И2 + С12- Хлорированная вода Н2Ѕ сероводород Н2 + С Пары водорода При взаимодействии водорода с азотом образуется аммиак H3N, что имеет большое практическое значение.
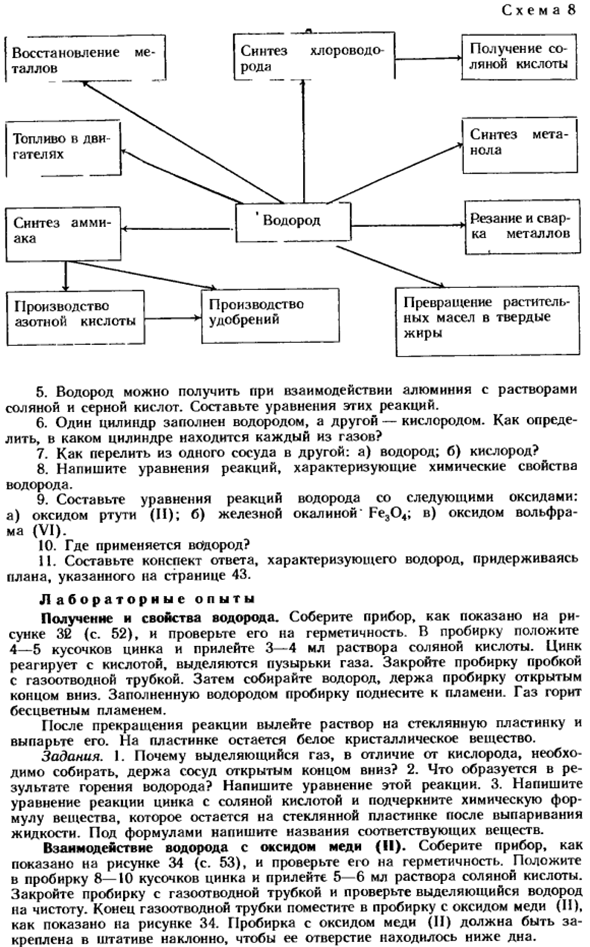
Водород также вступает в реакцию с активным металлом с образованием цветных металлов. Я Я Я Я Из всех соединений-гидриды: NaH, CaH2. Использование водорода основано на его легкости и способности гореть с выделением большого количества тепла. Водород также используется в качестве восстановителя для синтеза ценных металлов и некоторых веществ(схема 81). Ответьте на вопросы 6-11. ■ 1.
Контур водородного элемента. Напишите формулу известного вам соединения водорода. 2.Объясните значение записи: 5H, 2H2, 6H и ZN2. 3.Как часто водород встречается в природе? Вычислите, какие вещества богаты водородом: вода H20 или метан CH4. 4.Создайте уравнение реакции, которое может произвести водород. Пожалуйста, объясните, к какому типу относятся эти реакции.
- Описание причины, по которой стрелки отмечены разными цветами- се 4.Схема 8 5.Водород получают взаимодействием алюминия с растворами соляной и серной кислот. Создайте уравнения для этих реакций. 6. Один цилиндр заполнен водородом, а другой-кислородом. Как проверить баллон, содержащий каждый газ?
7.Как перейти из одного сосуда в другой: а) водород; б) кислород? 8.Напишите уравнения реакций, характеризующие химические свойства водорода. 9.Сформулируйте уравнение реакции водорода со следующими оксидами: а) оксид ртути (II). b) оксид железа ’ Fe304; c) оксид вольфрама (VI). 10.Где используется водород?
11. Следуйте 43-страничному плану, чтобы создать краткое описание реакции водорода. Людмила Фирмаль
Лабораторные опыты Получение и характеристики водорода. Рис. 32 (стр. 52) соберите устройство для проверки на наличие утечек. В пробирку помещают 4-5 кусочков цинка и добавляют 3-4 мл раствора соляной кислоты. Цинк реагирует с кислотами, и пузырьки выделяются. Закройте трубку вентиляционной пробкой. Затем нажмите на открытый конец трубки, чтобы собрать водород. Против пламени помещают трубку, наполненную водородом. Газ горит бесцветным пламенем.
После окончания реакции раствор выливают на стеклянную пластину и выпаривают. На пластине остается белое кристаллическое вещество. Задача. 1.Полученный газ, в отличие от кислорода, необходим для сбора, и зачем держать контейнер открытым? 2.Что образуется в результате сгорания водорода? Напишите уравнение этой реакции.
3.Напишите формулу реакции цинка и соляной кислоты, выделив химическую формулу вещества, которое остается на стеклянной пластине после испарения жидкости. Под формулой напишите название соответствующего вещества. Взаимодействие водорода и оксида меди (II).Рисунок 34 (стр. 53) соберите устройство для проверки на наличие утечек.
В пробирку помещают 8-10 кусочков цинка и добавляют 5-6 мл раствора соляной кислоты. Закройте вентиляционную трубу и проверьте наличие водорода для обеспечения cleanliness. As как показано на рисунке 34, концы водопроводной трубы помещены в медную (II) оксидную трубку. Трубка из оксида меди (II) должна быть прикреплена наклонно к штативу так, чтобы отверстие находилось ниже дна.
Нагрейте трубку в том месте, где есть медь (II) oxide. As как только вы заметите появление красного порошка, прекратите нагрев. Красное вещество образуется из черного порошка оксида меди (II), и капля воды стекает по стенкам трубки. Задача. 1.Почему необходимо проверять чистоту перед нагревом оксида меди (II) в атмосфере водорода?
2.Почему трубка из оксида меди (II) закреплена на треноге, наклоненной к открытому концу? 3.Почему он нуждался в нагреве только перед раскалением оксида меди (II)? 4.Это объясняет, почему красное вещество образовалось из черного порошка. 5.Напишите уравнение реакции водорода с оксидом меди (II).С какой реакцией это связано? 6.Какие характеристики водорода подтверждены в этом эксперименте?
Взаимодействие воды с натрием и кальцием. Возьмите небольшой кусочек натрия и замочите его в пробирке с водой. Натрий, плавающий на поверхности воды, бурно реагирует с ней. Рис. 33 (стр. 52) поместите воронку в трубку, как показано на рисунке. Зажгите освобожденный gas. To к раствору, полученному в результате реакции, добавляют несколько капель раствора фенолфталеина. Сделайте то же самое с кальцием.
Часть кальция опускается на дно трубки и реагирует с водой, но он менее активен, чем натрий. Жидкость, образовавшаяся в результате реакции натрия и кальция с водой, на ощупь мыльная, а фенолфталеин окрашен в малиновый цвет. Задача. I. Почему натрий перемещался по поверхности воды? 2.Какие вещества образуются в растворе? 3.Какие газы выделяются? 4.Напишите уравнение реакции на progress. To к какому типу вы принадлежите?
Смотрите также:
| Водород, его общая характеристика и нахождение в природе | Вода. Состав воды |
| Получение водорода | Вода в природе и способы ее очистки |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.

