| 🎓 Заказ №: 22215 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Составьте в молекулярной форме уравнения реакций, которые выражаются следующими краткими ионно-молекулярными уравнениями: 313 Н + + NO2¯ = HNO2
Решение: HCl NaNO2 NaCl HNO2 1) К окислительно — восстановительным реакциям относятся реакции в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции. 2) Под степенью окисления понимается условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. Степень окисления обозначается арабской цифрой, которую ставят перед символом элемента, со знаком «+» или «−», соответствующим отдаче или приобретению электронов. Для элементов, проявляющих в своих соединениях различные степени окисления, существуют понятия высшей (максимальной положительной) и низшей (минимальной отрицательной) степеней окисления. Низшая степень окисления химического элемента обычно численно равна разности между номером группы в Периодической системе Д.И. Менделеева, в которой расположен химический элемент, и числом 8. Например, азот находится в VA группе, значит его низшая степень окисления равна (-3): 5-8 = -3; сера находится в VIA группе, значит её низшая степень окисления равна (-2): 6–8 = -2 и т.д. Промежуточная степень окисления – степень окисления, имеющая значение между низшей и высшей степенями. Промежуточных степеней окисления может быть больше одной. 3) Восстановительные свойства способны проявлять частицы (атомы, ионы, молекулы), содержащие атомы элементов в низшей и промежуточных степенях окисления. 4) Окислительные свойства способны проявлять частицы (атомы, ионы, молекулы), содержащие атомы элементов в высшей и промежуточных степенях окисления.

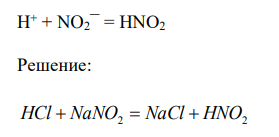


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Составьте уравнения реакций, расставив коэффициенты методом электронноионного (или электронного) баланса: № задания Металл Окислитель 671. Cu HNO3 (конц.)
- Закончите уравнения реакций, расставив коэффициенты методом электронноионного (или электронного) баланса: б) щелочная среда Br2 + Bi2O3 + KOH = KBiO3 + KBr + H2O
- Составьте в молекулярной форме уравнения реакций, которые выражаются следующими краткими ионно-молекулярными уравнениями: Al(OH)3 + OH¯ [Al(OH)4]¯
- Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: гидроксидом бария и хлоридом кобальта (II)
- Составьте в молекулярной форме уравнения реакций, которые выражаются следующими краткими ионно-молекулярными уравнениями: Zn2+ + H2S ZnS + 2H+
- Полное решение а) +2, 6; б) +3, 6; в) +3, 3.
- Определите степень окисления элемента в оксидах, назовите их в соответствии с международной номенклатурой. Напишите эмпирические формулы оснований или кислот, соответствующих данным оксидам K2O
- Определите концентрации ионов (моль/л) в водных растворах следующих сильных электролитов: 0,15 М азотной кислоты
- Закончите уравнения реакций, расставив коэффициенты методом электронноионного (или электронного) баланса: а) кислая среда Na2SO3 + K2Cr2O7 + H2SO4 = Na2SO4 + Cr2(SO4)3 + K2SO4 + H2O
- Молярная концентрация. Молярная концентрация эквивалента (нормальная концентрация). Взаимный переход от одних видов выражения концентрации к другим
