| 🎓 Заказ №: 22220 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
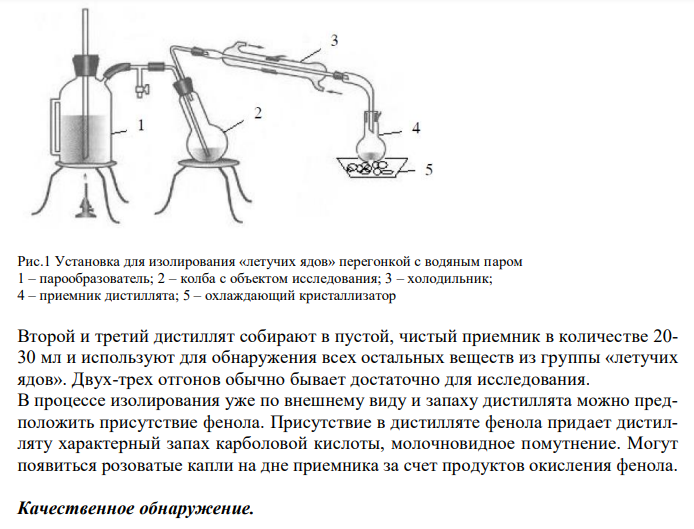
Схема химико-токсикологического исследования фенола.
Фенол, гидроксибензол C6H5OH – простейший представитель класса фенолов. Представляет собой длинные игольчатые кристаллы или бесцветную кристаллическую массу со своеобразным запахом. На воздухе он постепенно розовеет. Фенол легко растворяется в этиловом спирте, диэтиловом эфире, хлороформе, жирных маслах, растворах едких щелочей. Умеренно растворим в воде (1:20), бензоле, ацетоне. Метаболизм. Фенол всасывается в кровь через слизистые оболочки и кожу, а затем распределяется в органах и тканях. Часть фенола в организме связывается с белками, а часть – подвергается окислению с образованием гидрохинона и пирокатехина. Несвязанный фенол и его метаболиты (гидрохинон и пирокатехин) выделяются с мочой в виде конъюгатов с сульфатами и глюкуроновой кислотой. Изолирование. Фенол легко испаряется, поэтому для его изолирования применяют метод перегонки с водяным паром. Наиболее важными объектами для судебно-химической экспертизы служат моча, почки, печень, сердце, кровь. Объект в количестве 100 г помещают в круглодонную колбу таким образом, чтобы она заполнилась не более чем на 1/3 её объема, подкисляют кислотой щавелевой или виннокаменной до рН 2-3 и подвергают перегонке. Подкисление необходимо, поскольку фенол перегоняется из кислой среды. Дистилляция с водяным паром проводится в специальном приборе (рис.1), который состоит из герметично соединенных друг с другом парообразователя, колбы с объектом исследования, холодильника и приемника. Дистилляцию проводят медленно, так, чтобы можно было считать капли отгона. Собирают 2-3 дистиллята. Первый в количестве 1-3 мл собирают в приемник с 5 % раствором натрия гидроксида для улавливания легколетучей синильной кислоты и превращения ее в нелетучий цианид натрия. При этом аллонж холодильника должен быть погружен в раствор NaOH, чтобы избежать потерь летучей синильной кислоты. Весь первый дистиллят используют для обнаружения синильной кислоты. Рис.1 Установка для изолирования «летучих ядов» перегонкой с водяным паром 1 – парообразователь; 2 – колба с объектом исследования; 3 – холодильник; 4 – приемник дистиллята; 5 – охлаждающий кристаллизатор Второй и третий дистиллят собирают в пустой, чистый приемник в количестве 20- 30 мл и используют для обнаружения всех остальных веществ из группы «летучих ядов». Двух-трех отгонов обычно бывает достаточно для исследования. В процессе изолирования уже по внешнему виду и запаху дистиллята можно предположить присутствие фенола. Присутствие в дистилляте фенола придает дистилляту характерный запах карболовой кислоты, молочновидное помутнение. Могут появиться розоватые капли на дне приемника за счет продуктов окисления фенола. Качественное обнаружение. Для обнаружения фенола используется часть второго дистилята, который подвергается пробоподготовке, так как проведение реакций на фенол мешают карбоновые кислоты и этанол. Дистиллят подщелачивают раствором гидрокарбоната натрия до щелочной реакции, вносят в делительную воронку и извлекают 2-3 порциями диэтилового эфира по 5 мл. Эфирные вытяжки объединяют и выпаривают при комнатной температуре досуха. Сухой остаток растворяют в 2-3 мл воды и проводят качественные реакции на фенол. 1. Реакция с бромной водой. К 0,5-1,0 мл исследуемого раствора прибавляют 3-5 капель бромной воды. Образуется желтовато-белый осадок трибромфенола, растворимый в избытке реактива.



| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Найти массу серебра, находящегося в виде ионов в 0,5л 0,1 М раствора ди(тиосульфато)аргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия.
- Написать в полной и сокращенной формах ионно-молекулярные уравнения реакций, протекающих при взаимодействии КОН + Н2СО3.
- Вычислить степень диссоциации и рН раствора азотистой кислоты, в 200 мл которого содержится 1,88 г азотистой кислоты.
- Реакции выражаются схемами: KClO3 + Na2SO3 КСl + Na2SO4
- Как изменяется атомный радиус и электроотрицательность в группе и периоде?
- Методы редоксиметрического титрования. Рабочие растворы каждого метода.
- При добавлении к 100 мл артезианской воды раствора роданида калия, проба воды окрасилась в ярко-красный цвет. Какой вывод можно сделать по наблюдаемому эффекту?
- Приведите современную формулировку периодического закона. Объясните, почему первопричиной периодичности является заряд атома элемента, а не атомная масса или массовое число.
- Реакция идет по уравнению N2 + 3Н2 = 2NH3 Концентрации участвующих в ней веществ (моль/л): [N2] = 0,80; [Н2] = 1,5; [NH3] = 0,10.
- Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций H2S + Cl2 + H2O → H2SO4 + HCl
