Эбуллиоскопический закон
При нагревании жидкости давление насыщенного пара увеличивается. При некоторой температуре давление насыщенного пара становится равным внешнему давлению и жидкость закипает. Температура, при которой давление насыщенного пара над жидкостью равно внешнему давлению называют температурой кипения жидкости.
Индивидуальные вещества характеризуются строго определенными температурами переходов из одного агрегатного состояния в другое, иначе обстоит с растворами.
Давление насыщенного пара растворителя над раствором меньше, чем давление насыщенного пара над чистым растворителем (А) 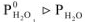 (рис. 2). Следовательно, чтобы давление насыщенного пара стало равным внешнему давлению раствор необходимо нагреть до более высокой температуры, чем чистый растворитель.
(рис. 2). Следовательно, чтобы давление насыщенного пара стало равным внешнему давлению раствор необходимо нагреть до более высокой температуры, чем чистый растворитель.
Температура кипения раствора 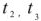 , выше температуры кипения чистого растворителя для воды
, выше температуры кипения чистого растворителя для воды 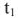 = 100 °C. (рис. 4).
= 100 °C. (рис. 4).
Давление насыщенного пара над раствором уменьшается с увеличением концентрации раствора, следовательно, чем выше концентрация раствора, гем выше температура кипения. 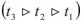 ( рис.4 )
( рис.4 )
Разность между температурами кипения раствора и чистого растворителя (воды) называется повышением температуры кипения раствора. 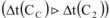 (рис. 4).
(рис. 4).
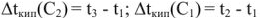
Для разбавленных растворов неэлектролитов повышение температуры кипения пропорционально моляльности растворенного вещества в растворе:
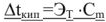
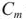 — Моляльность растворенного вещества в растворе, моль/кг;
— Моляльность растворенного вещества в растворе, моль/кг;
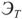 — эбуллиоскопическая постоянная растворителя.
— эбуллиоскопическая постоянная растворителя.
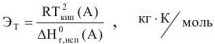
где:
R — газовая постоянная, R = 8,314, 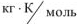
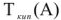 — абсолютная температура кипения чистого растворителя, К;
— абсолютная температура кипения чистого растворителя, К;
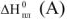 — энтальпия процесса испарения чистого растворителя, кДж.
— энтальпия процесса испарения чистого растворителя, кДж.
(Вода — 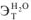 = 0,52; ацетон —
= 0,52; ацетон — 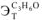 =2,6; бензол —
=2,6; бензол — 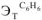 =2,57; этиловый спирт —
=2,57; этиловый спирт — 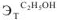 = 1,16 ).
= 1,16 ).
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Диаграмма состояния воды в химии |
| Топоскопический закон Рауля |
| Криоскопический закон |
| Осмос в химии |

