Химические свойства воды
Молекулы воды отличаются устойчивостью к нагреванию. Однако при температурах выше 1000″С водяной пар начинает разлагаться:
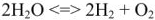
Данный процесс называется термической диссоциацией. Поскольку диссоциация воды происходит с поглощением тепла, то согласно принципу Ле Шателье с повышением температуры процесс термической диссоциации смещается в сторону образования водорода и кислорода. Однако даже при 2000°С степень термической диссоциации не превышает 2%. При температурах ниже 1000“С равновесие сдвигается в сторону образования воды.
Вода является очень реакционно-способным веществом:
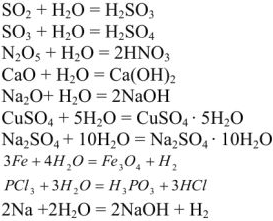
Вода обладает каталитической способностью
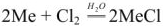
Вода способна соединяться с рядом веществ, находящихся в обычных условиях в газообразном состоянии, образуя при этом так называемые гидраты газов.
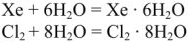
Данные соединения выпадают в виде кристаллов в температурном интервале 0-24 °C. Подобные соединения возникают в результате заполнения молекулами газа межмолекулярных полостей, имеющихся в структуре воды, такие соединения называются клатратами.
Жесткость воды.
Жесткость воды является одним из важнейших технологических показателей воды. Пройдя через известковые горные породы и почвы, вода извлекает растворимые гидрокарбонаты кальция, магния и железа (II) 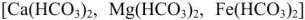 , а также сульфаты, хлориды, нитраты, силикаты, фосфаты этих металлов. При использовании жесткой воды в качестве теплоносителя на внутренних стенках паровых котлов и трубопроводов осаждаются малорастворимые карбонаты, гидроксиды
, а также сульфаты, хлориды, нитраты, силикаты, фосфаты этих металлов. При использовании жесткой воды в качестве теплоносителя на внутренних стенках паровых котлов и трубопроводов осаждаются малорастворимые карбонаты, гидроксиды 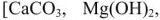 ,
, 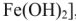 , образуя накипь. Накипь имеет низкую теплопроводность, поэтому вызывает локальный перегрев стенок котла, что может привести к быстрому испарению воды и взрыву. Жесткую воду нельзя использовать для приготовления строительных растворов, она вызывает коррозию металлических конструкций.
, образуя накипь. Накипь имеет низкую теплопроводность, поэтому вызывает локальный перегрев стенок котла, что может привести к быстрому испарению воды и взрыву. Жесткую воду нельзя использовать для приготовления строительных растворов, она вызывает коррозию металлических конструкций.
Агрессивность жидких сред по отношению к бетону зависит от концентрации углекислого газа и жесткости воды. При отсутствии в воде карбонатов может происходить растворение цементного камня — его выщелачивание (коррозия) и снижение прочности бетона. Замедляющее действие карбонатов на развитие выщелачивания в бетоне начинает оказываться при жесткости воды более 1 ммоль/л.
Анализы показывают, что чем больше карбонатная жесткость, тем выше в ней допустимая для бетона концентрация 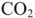 . Вместе с тем, чем больше в среде ионов
. Вместе с тем, чем больше в среде ионов 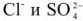 , тем ниже допустимая концентрация
, тем ниже допустимая концентрация 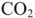 . Воздействие воды, содержащей магниевые соли приводит к быстрому разрушению бетона (глубинные грунтовые и морские воды).
. Воздействие воды, содержащей магниевые соли приводит к быстрому разрушению бетона (глубинные грунтовые и морские воды).
Качественная и количественная характеристики жесткости. По качественному составу соединений, имеющихся в воде различают кальциевую жесткость, обусловленную ионами кальция 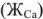 , магниевую жесткость -ионами магния
, магниевую жесткость -ионами магния 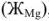 , железиевую жесткость
, железиевую жесткость 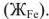 . Гидрокарбонаты
. Гидрокарбонаты 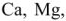
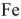 обуславливают карбонатную или временную жесткость воды
обуславливают карбонатную или временную жесткость воды 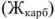 , остальные растворимые соединения соединения этих металлов — постоянную жесткость воды
, остальные растворимые соединения соединения этих металлов — постоянную жесткость воды 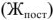 или некарбонатную. Сумма временной и постоянной жесткостей воды называется общей жесткостью воды
или некарбонатную. Сумма временной и постоянной жесткостей воды называется общей жесткостью воды 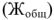 .
.
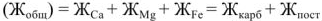
Количественно жесткость воды (Ж, ммоль/л) определяется суммарным содержанием миллимоль эквивалентов веществ, содержащихся в воде и обуславливающих жесткость, или веществ, прибавляемых для устранения жесткости:
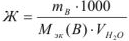
где 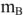 — масса вещества, г;
— масса вещества, г; 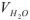 — объем воды, л;
— объем воды, л; 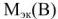 — молярная масса эквивалента вещества, г/моль.
— молярная масса эквивалента вещества, г/моль. 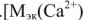 40/2 (20 г/моль);
40/2 (20 г/моль); 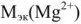 = 24/2 (12 г/моль);
= 24/2 (12 г/моль); 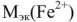 = 56/2 (28 г/моль). Молярная масса эквивалентов гидрокарбонатов, сульфатов, хлоридов, нитратов, силикатов этих металлов равна половине молярной массы этих солей. Различают природную воду: очень мягкую — с жесткостью до 1,5 ммоль/л, мягкую — от 1,5 до 4, средней жесткости — от 4 до 8, жесткую от 8 до 12, очень жесткую — свыше 12 ммоль/л. Жесткость воды в морях ~ 65 ммоль/л, в океанах ~ 130 ммоль/л. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль/л.
= 56/2 (28 г/моль). Молярная масса эквивалентов гидрокарбонатов, сульфатов, хлоридов, нитратов, силикатов этих металлов равна половине молярной массы этих солей. Различают природную воду: очень мягкую — с жесткостью до 1,5 ммоль/л, мягкую — от 1,5 до 4, средней жесткости — от 4 до 8, жесткую от 8 до 12, очень жесткую — свыше 12 ммоль/л. Жесткость воды в морях ~ 65 ммоль/л, в океанах ~ 130 ммоль/л. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль/л.
Задача. Какова качественная и количественная характеристика жесткости воды, если в 10 л ее содержится 915 мг ионов 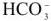 , 840 мг ионов
, 840 мг ионов 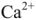 в пересчете на
в пересчете на 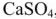 , 910 мг ионов
, 910 мг ионов 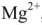 , 560 мг ионов
, 560 мг ионов 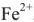 , Прочие ионы отсутствуют.
, Прочие ионы отсутствуют.
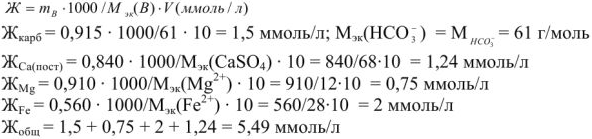
Определение общей жесткости воды. В настоящее время для определения общей жесткости воды используется метод трилонометрического титрования. В основе метода лежит взаимодействие трилона Б (комплексона III), который является двузамещенной натриевой солью этилендиаминтетрауксусной кислоты (ЭДТА) с катионами металлов. Реакцию титрования пробы жесткой воды ЭДТА можно изобразить уравнением:
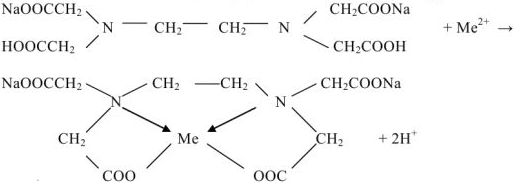
Метод основан на способности трилона образовывать с катионами металлов (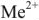 ) малодиссоциированные комплексные соединения. Для связывания освобождающихся ионов Н1 в титруемую пробу вносят аммиачный буфер (pH — 10). Фиксирование эквивалентной точки осуществляется
) малодиссоциированные комплексные соединения. Для связывания освобождающихся ионов Н1 в титруемую пробу вносят аммиачный буфер (pH — 10). Фиксирование эквивалентной точки осуществляется
металлиндикатором, органическим красителем «кислотным хромтемносиним».
Общая жесткость воды по трилонометрическому методу определяется по формуле: 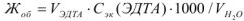 , ммоль/л
, ммоль/л
где 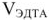 — объем трилона
— объем трилона 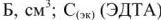 — молярная концентрация эквивалентов, трилона Б, моль/л;
— молярная концентрация эквивалентов, трилона Б, моль/л; 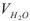 объем исследуемой воды,
объем исследуемой воды, 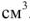 .
.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Ионно-молекулярные уравнения в химии |
| Физические свойства в химии |
| Методы умягчения воды в химии |
| Диаграмма состояния воды в химии |

