Оглавление:
Основные классы неорганических соединений
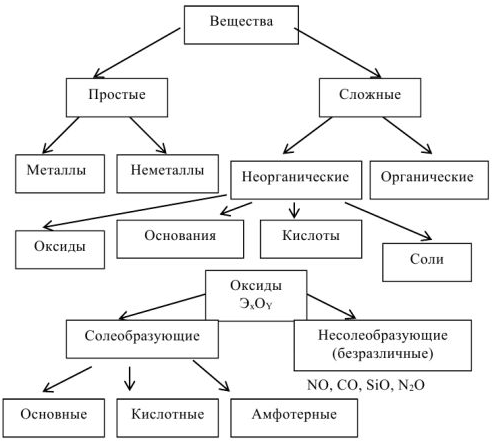

Свойства оксидов
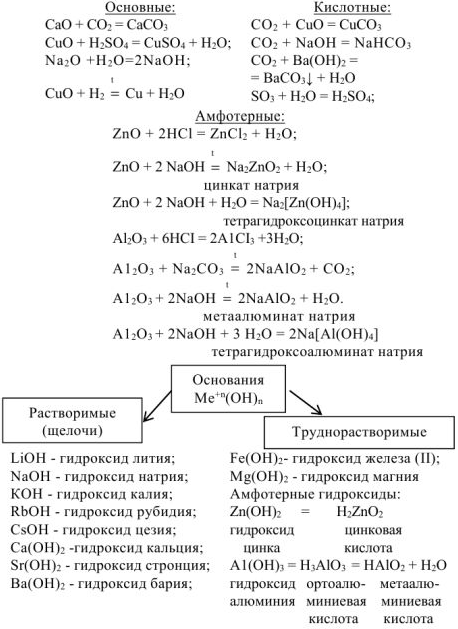
Свойства оснований
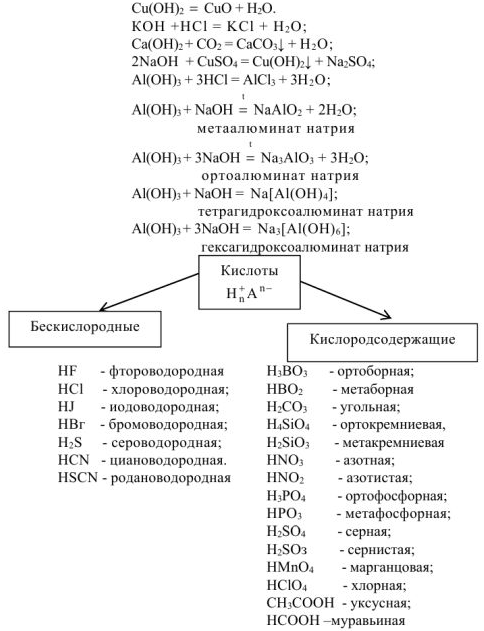
Свойства кислот
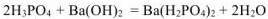
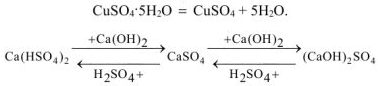
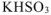 — гидросульфит калия;
— гидросульфит калия;
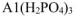 — дигидроортофосфат алюминия
— дигидроортофосфат алюминия
 — гидрокарбоиат кальция;
— гидрокарбоиат кальция;
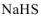 — гидросульфид натрия;
— гидросульфид натрия;
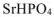 — гидроортофосфат стронция.
— гидроортофосфат стронция.
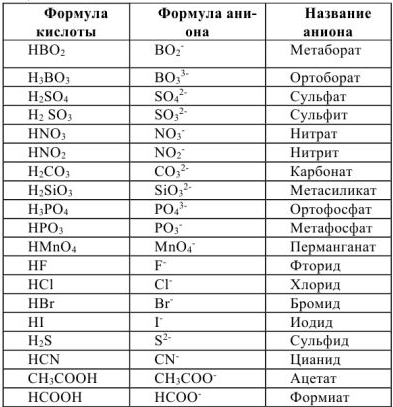
Таблица 1.1. Кислоты и их соли.
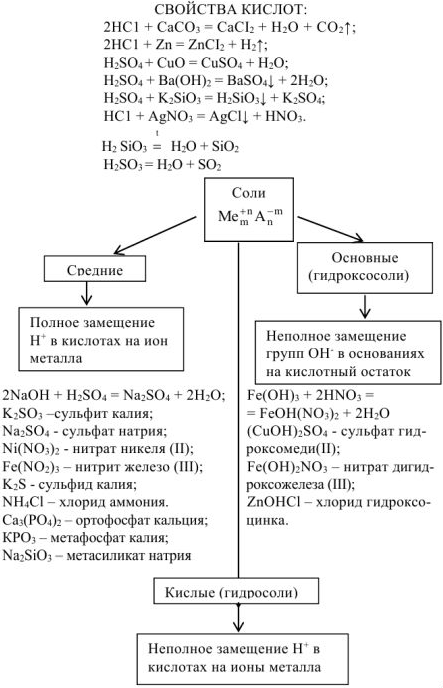
Свойства солей
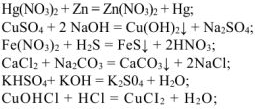
Некоторые правила определения степеней окисления элементов в химических соединениях
1. Степень окисления атомов в простых веществах равна нулю. Например; 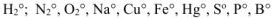 и др.
и др.
2. Атомы кислорода в основных классах неорганических соединений проявляют степень окисления (-2).
Например: 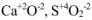 и т.д.
и т.д.
Исключения: фторид кислорода 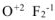 — степень окисления кислорода (+2), пероксиды — степень окисления кислорода (-1),
— степень окисления кислорода (+2), пероксиды — степень окисления кислорода (-1),
Например: 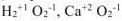
3. Атом водорода в основных классах неорганических соединений проявляет степень окисления (+ 1).
Например: 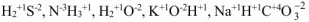
Исключения: гидриды металлов типа 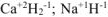 ; в которых степень окисления водорода (-1).
; в которых степень окисления водорода (-1).
- Металлы IA, IIА и IIIА главных подгрупп Периодической системы проявляют степень окисления равную номеру группы в которой находится этот элемент т.е. соответственно (+1), (+2) и (+3) (см. табл. 1.2).
Например: 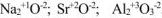
5. Алгебраическая сумма степеней окисления отдельных атомов, образующих молекулу, с учетом их стехиометрических индексов равна нулю. Например, можно определить степень окисления азота в молекуле 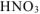 , зная степени окисления кислорода (-2) и водорода (+1):
, зная степени окисления кислорода (-2) и водорода (+1): 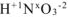
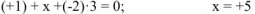
или степень окисления хрома в молекуле 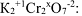
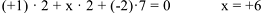
6. Атомы одного и того же элемента в различных соединениях могут иметь разные степени окисления, например:
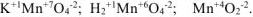
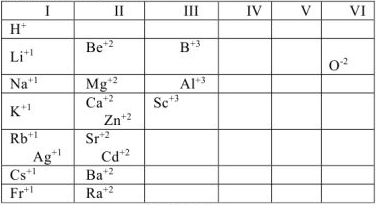
Таблица 1.2. Элементы, имеющие постоянную степень окисления в большинстве соединений
Задача 1.
а) Назвать следующие химические соединения и определить степень окисления всех элементов соединений: 
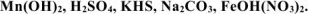
б) Написать формулы следующих химических соединений: оксид свинца (IV), сульфат лития, хлорид гидроксоцинка, дигидроортофосфат алюминия
Ответ:
а) 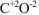 — оксид углерода (II),
— оксид углерода (II),
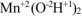 — гидроксид марганца (II),
— гидроксид марганца (II),
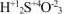 — сернистая кислота,
— сернистая кислота,
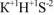 — гидросульфид калия,
— гидросульфид калия,
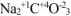 — карбонат натрия,
— карбонат натрия,
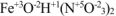 — нитрат гидроксожелеза (III).
— нитрат гидроксожелеза (III).
б) Оксид свинца (IV) — 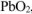 ,
,
сульфат лития — 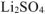 ,
,
хлорид гидроксоцинка — 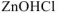
дигидроортофосфат алюминия — 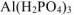
Задача 2.
Определить количество моль воды в формуле кристаллогидрата 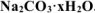 , если в результате прокаливания его масса изменилась от 1,43 до 0,53 г. Определить объем выделившейся парообразной воды при 200°С и давлении 98,2 кПа.
, если в результате прокаливания его масса изменилась от 1,43 до 0,53 г. Определить объем выделившейся парообразной воды при 200°С и давлении 98,2 кПа.

Решение:
При прокаливании кристаллогидрата протекает реакция:
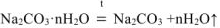
Р = 98 2кПа Na2CO3 nH2O = Na2CO3+пН2ОТ (1.1)
Находим массу воды 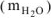 — выделившейся при разложении кристаллогидрата:
— выделившейся при разложении кристаллогидрата:
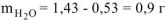
Расчет n ведем по уравнению реакции (1.1)
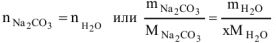 , тогда
, тогда
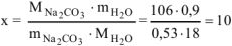
где 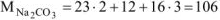 г/моль
г/моль
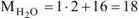 г/моль
г/моль
Формула кристаллогидрата 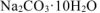
Рассчитываем объем выделившейся газообразной воды при
Т = 273 + 200 = 473 К и Р = 98,2 кПа по уравнению Менделеева-Клапейрона
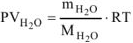
где 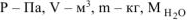 — кг/моль, R — 8,314 Дж/моль-К, Т-К.
— кг/моль, R — 8,314 Дж/моль-К, Т-К.
Откуда 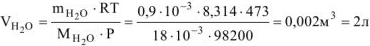
Ответ: формула кристаллогидрата: 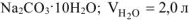
Задача 3.
Определить состав смеси (% масс.), содержащей карбонат магния (15 г) и оксид магния. Если после прокаливания смеси, полученный продукт вступил в реакцию с ортофосфорной кислотой и образовалось 80 г ортофосфата магния. Составить уравнения реакций

Решение:
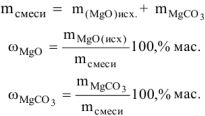
При прокаливании смеси протекает реакция
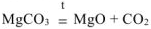
Тогда по этому уравнению
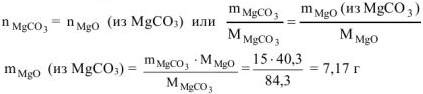
где 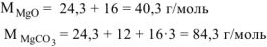
После прокаливания смесь состоит только из 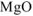
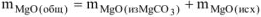
При взаимодействии продукта, полученного после прокаливания с ортофосфорной кислотой, протекает реакция
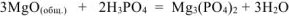
Тогда реагирует по уравнению
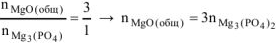
или
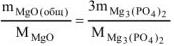
откуда 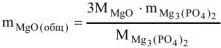
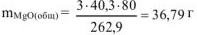
где 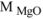 = 40,3 г/моль ,
= 40,3 г/моль , 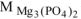 = 262,9 г/моль
= 262,9 г/моль
тогда 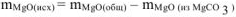 = 36,79 г — 7,17 г — 29,62 г
= 36,79 г — 7,17 г — 29,62 г
Таким образом
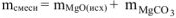 = 29,62 г + 15 г = 44,62 г
= 29,62 г + 15 г = 44,62 г
Состав исходной смеси
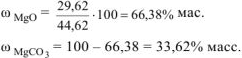
Задача 4.
При взаимодействии 1,8 г технического карбоната кальция (мела) с 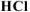 выделилось 400
выделилось 400 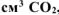 , собранного над водным раствором
, собранного над водным раствором 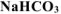 и измеренного при температуре 288 К и давлении 730 мм рт.ст. Давление паров воды при 288 К равно 12,79 мм рт.ст. Определить содержание
и измеренного при температуре 288 К и давлении 730 мм рт.ст. Давление паров воды при 288 К равно 12,79 мм рт.ст. Определить содержание 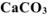 в техническом карбонате кальция в процентах.
в техническом карбонате кальция в процентах.

Решение:
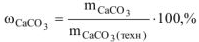
Так как, примеси, содержащиеся в техническом 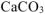 не взаимодействуют с
не взаимодействуют с 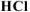 с образованием
с образованием 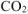 , то массу чистого карбоната кальция
, то массу чистого карбоната кальция 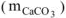 определяем по уравнению реакции (1.4):
определяем по уравнению реакции (1.4):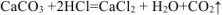
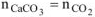
Или 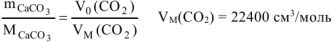
тогда 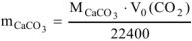
где 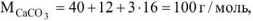
где 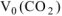 — объем выделившегося
— объем выделившегося 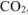 , приведенный к нормальным условиям.
, приведенный к нормальным условиям.
Для определения 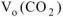 воспользуемся объединенным газовым законом:
воспользуемся объединенным газовым законом:
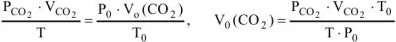
где 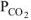 — парциальное давление
— парциальное давление 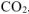 , так как
, так как 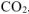 собран над водным раствором
собран над водным раствором 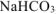 , то
, то
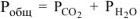 , тогда
, тогда
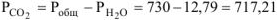 мм рт.ст.
мм рт.ст.

тогда 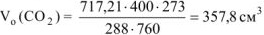
Определяем массу чистого  по формуле (1.5):
по формуле (1.5):
 , тогда
, тогда
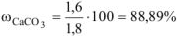
Ответ: содержание  в меле 88,89%.
в меле 88,89%.
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:
| Эквивалент. Закон эквивалентов задачи с решением |
| Способы выражения состава раствора задачи с решением |
| Металлы VII группы задачи с решением |
| Металлы VIII группы задачи с решением |

