Оглавление:






Двойные системы. Кривые плавления. Эвтектические точки.
- Двойственная система. Кривые плавления. Эвтектическая точка Рассмотрим систему, состоящую из 2 компонентов A и B, которые не образуют твердого раствора. Приложите давление к системе, которое превышает давление пара над жидкой смесью. Единственными фазами, которые могут существовать в системе, являются раствор A-f B, твердый компонент A и твердый компонент B. предположим, что компоненты A и B не взаимодействуют химически друг с другом. Рис. 13.5.
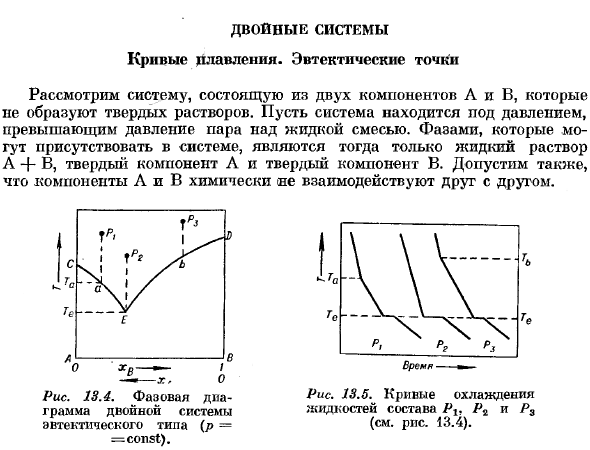
Состав (см. Рисунок 13.4). Рис. 13.4.Фазовая диаграмма эвтектической 2-компонентной системы (/>=const). Во-первых, рассмотрим 2-фазный раствор+твердая фаза system. In в этом случае c = 2, φ= 2, K = 0, а в соответствии с фазовыми правилами, = 2, то есть 2-переменная system. In в такой системе можно придать любое значение 2 интенсивным переменным. Например, молярная доля и давление Р ХВ в растворе. Температура, при которой устанавливается равновесие, является функцией этих 2 переменных.
In в этом случае диаграмма равновесия может быть представлена на плоскости, как это сделано на рисунке. 13.4. Кривая CE определяет равновесную температуру между раствором и твердой фазой A в зависимости от концентрации xB в растворе. Аналогично линия DE соответствует равновесию раствора и твердого компонента B. At пересечение этих 2 кривых E, решение уравновешивается с обоими кристаллами компонентов A и B. точка E называется эвтектической. Так как бинарная система в присутствии 3 фаз (раствор, твердый компонент а, твердый компонент в) равна, то положение эвтектической точки зависит только от приложенной pressure. In дело в том, что из-за малейшего влияния давления на свойства жидкостей и твердых тел (см. Главу 11) смещение эвтектической точки под действием давления очень мало (впрочем, см. Главу 21, Главу 5).
Для многих целей полезно рассматривать систему, которая находится под постоянным давлением, например атмосферным. Людмила Фирмаль
Все точки На рисунке выше кривой CED удовлетворяют условиям только при определенных давлениях 1 фаза-L-f-в растворе. Однофазные системы являются 3-переменными, и все переменные T, p и xb могут быть изменены произвольно. Когда раствор охлаждается, точка, представленная точкой, представляющей состояние системы, перемещается по линии P \ A. температура упадет, а состав раствора не изменится change. At в точке а кристаллы компонента а начинают осаждаться, увеличивая концентрацию компонента в растворе.
Теперь система может поддерживать свое равновесное состояние только при условии, что изменение состояния жидкой фазы происходит вдоль линии aE. At точка е, как L, так и B кристаллизуются и состав раствора должен быть постоянным, поэтому обе твердые фазы образуются с одинаковым молярным соотношением A: B, которое присутствует в эвтектическом растворе. Поэтому затвердевание раствора начинается при температуре Tn при температуре a и заканчивается при эвтектической температуре Tc. Аналогично, состояние раствора, впервые представленного в точке P3, изменяется, когда он охлаждается вдоль пути P-LSE.
Затвердевание начинается в точке B, состав и температура раствора изменяется вдоль кривой BE, а последняя часть твердого вещества кристаллизуется при эвтектической температуре Te и имеет эвтектический состав. Наконец, раствор с эвтектическим составом, соответствующим точке Pb, полностью затвердевает при эвтектической температуре. Кривые охлаждения (т. е. кривые, построенные в координатах температура-время) для растворов, начальным составом которых является Pu Pu и Pu, показаны на Рис.1. 13.5.Кривые Pi и P3 имеют излом при температурах Ta и Tb соответственно, и когда раствор достигает эвтектического состава, температура больше не изменяется до полного удаления жидкой фазы.
Экспериментальные исследования кривых охлаждения жидких растворов во всем диапазоне концентраций позволяют построить фазовую диаграмму. Образование соединений в бинарных системах Если A и B взаимодействуют, образуя C, то c = 3, r ’= 1 и c-r’ = 2, как в предыдущем примере. Таким образом, образование аддуктов не изменяет изменчивости системы, а ее поведение характеризуется аналогичной кривой, описанной выше, но несколько более сложной. Этот случай подробно рассматривается в главах XXIII и XXIX. Воздействие воздуха До сих пор мы предполагали, что все эксперименты будут проводиться в отсутствие газовой фазы.
- Однако при рассмотрении системы в присутствии воздуха тот же вывод достигается потому, что добавление новой фазы»(паровой фазы) и нового компонента (воздуха) не изменяет изменчивость системы. Поскольку воздух не изменяет своего состава, его можно рассматривать как 1 компонент (соотношение N2: O2 не изменяется, поэтому не стоит учитывать изменение состава за счет испарения компонента раствора) 2.
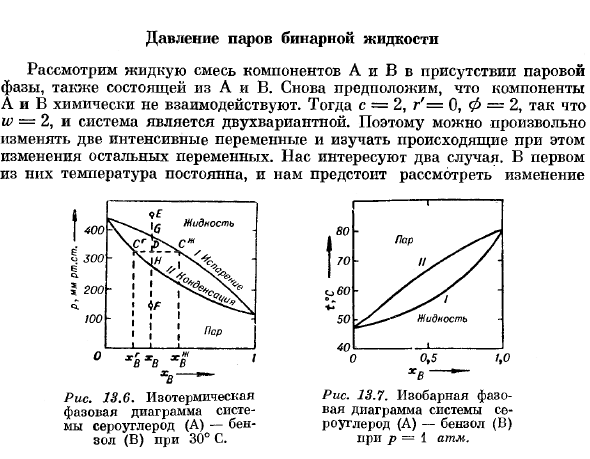
Эвтектика-это слово греческого происхождения, которое можно перевести как»переплетение».Это связано с тем, что объект, образованный тауудом в эвтектической концентрации, представляет собой тесную смесь кристаллов а и D. 2 в некоторых случаях необходимо учитывать различную растворимость газов, составляющих конденсированную фазу воздуха. (Эд.) давление пара двухкомпонентной жидкости Жидкость Рис. 13.6. Изотермическая фазовая диаграмма сероуглерода (а) — бензола (Б) при 30°C Рисунок Ж3. 7.Изобарная фазовая диаграмма системы сероуглерод (а) — бензол(13), Р = 1 атм. hw. Рассмотрим жидкую смесь компонентов А и в, состоящую из А и в, в присутствии газовой фазы.
Опять же, мы предполагаем, что компоненты A и B не взаимодействуют химически. Тогда c = 2, r ’= 0, Φ-2, следовательно, w-2, Система a bivariate. So вы можете произвольно изменить 2 централизованные переменные и посмотреть на изменения в остальных переменных. Меня интересует 2 cases. In первый из них, температура стоит и изменения нужно учитывать Давление и состав пара при изменении состава жидкости определяют по молярной доле a: b. во 2-м случае общее давление является постоянным, и учитывается зависимость равновесной температуры и состава пара от состава жидкости. Рис. 13.6, кривая I, определяет общее давление смеси сероуглерода (А) и бензола (Б) при постоянной температуре 30°С в зависимости от молярной доли B в жидкой фазе xv.
As в качестве независимой переменной можно также выбрать состав пара (xv) и построить кривую II зависимости p от x. наиболее важной характеристикой этого рисунка является то, что, например, если провести горизонтальную линию, пересекающую кривые I и II в точках Cj и C1, то эти точки будут одинаковыми Программа Давление определяет состав жидкости xn и пара xv, которые находятся в равновесии при давлении x. кривая I показана как кривая кипения (испарения), кривая II показана как кривая конденсации. Точка Е над кривой I соответствует жидкости в составе Xb. Эта жидкость имеет слишком высокое давление для образования паровой фазы. Аналогично, точка F соответствует паровой фазе того же состава. Наконец, точка D в области 2-кривой показывает 2-фазную систему, состоящую из жидкости и пара Cr с таким массовым соотношением, что вся система имеет общий состав xv. равный x * in и hgv.
Соотношение количества этих 2 фаз можно рассчитать следующим образом: n — общее количество молей в системе, а xv-общая молярная доля компонента В. г. ПВЛ-ПВ Хп ’-■-* ФВ + НБ + НС + НС Пж_ -nnv ~ ~ ХВ-X™ ’ Поэтому доля молей в жидкой и газовой фазах обратно пропорциональна отношению сегмента DC к CrD. Так, если точка D находится вблизи кривой кипения, то система почти полностью состоит из жидкости phases. As точка D приближается к кривой конденсации, все больше и больше систем превращается в пар. 11p еще одним способом описания поведения такого типа систем считается система, находящаяся под постоянным давлением (рис.13.7).Кривая I Состав жидкости определяет температуру кипения в зависимости от xjI Р.
Кривая II определяет состав пара xv, который находится в равновесии с жидкостью при заданной температуре. Диаграмма плавления твердого раствора В отличие от случая, рассмотренного в начале этого раздела, где твердые вещества А и В могут образовывать твердые растворы, фазовая диаграмма во многом напоминает фигуру, которую мы только что описали для жидкости-пара equilibrium. At постоянное внешнее давление, диаграмма принимает вид, показанный на рисунке 13.8.
Кривая Ликвидуса II, называемая кривой II, определяет температуру, при которой начинается кристаллизация в растворах различного состава, а кривая II, называемая Кривой Солидуса. Людмила Фирмаль
Смотрите также:
| Правило фаз Гиббса и теорема Дюгема. Правило фаз | Тройные системы |
| Однокомпонентные системы | Термодинамическое состояние |

