| 🎓 Заказ №: 22220 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
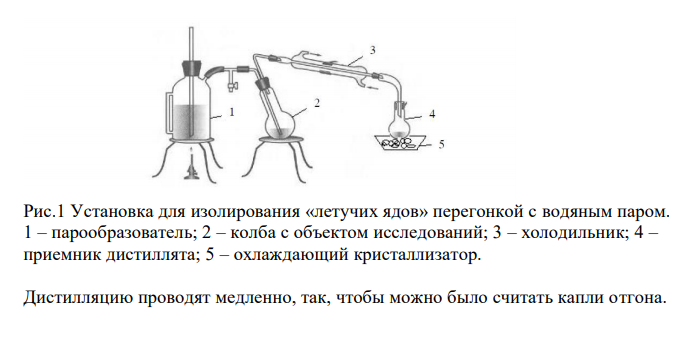
Схема химико-токсикологического исследования уксусной кислоты.
Ответ: Уксусная кислота Основные физические и химические свойства Уксусная кислота – бесцветная жидкость с резким характерным запахом. Безводная уксусная кислота плавится при температуре 16,64 °С. Смешивается с водой во всех соотношениях, растворяется в спирте, эфире, глицерине, органических растворителях. Метаболизм Метаболизм уксусной кислоты происходит по пути её окисления в организме до оксида углерода (IV) и воды Методы изолирования Уксусную кислоту изолируют перегонкой с водяным паром. Навеску объекта массой 100 г тщательно измельчают, смешивают с водой до густой кашицы, помещают в круглодонную колбу таким образом, чтобы она заполнилась не более чем на 1/3 её объема, подкисляют серной или фосфорной кислотой и подвергают перегонке. Дистилляция с водяным паром проводится в специальном приборе, который состоит из герметично соединенных друг с другом парообразователя, колбы с объектом исследо-вания, холодильника и приемника. Парообразующую трубку погружают в кашицеобраз-ную массу объекта в колбе почти до дна. Все соединения должны быть герметичны. Паро-образователь с водой предварительно нагревают для выделения «сухого» пара. Рис.1 Установка для изолирования «летучих ядов» перегонкой с водяным паром. 1 – парообразователь; 2 – колба с объектом исследований; 3 – холодильник; 4 – приемник дистиллята; 5 – охлаждающий кристаллизатор. Дистилляцию проводят медленно, так, чтобы можно было считать капли отгона. Первую порцию в количестве 3 мл собирают в приемник с 5 % раствором натрия гидроксида и используют только для обнаружения синильной кислоты. Вторую порцию дистиллята (25-50 мл) используют для качественного обнаружения и количественного определения уксусной кислоты. Это очень простой, быстрый, экономичный метода, не требует специальной аппаратуры. Уксусная кислота изолируется в чистом виде, только сильно разбавлена водой. Перегонку с водяным паром можно рассматривать не только как метод изолирования, но и как метод очистки. Второй метод изолирования уксусной кислоты заключается в извлечении её спиртом с последующим подщелачиванием спиртового извлечения. Полученную вытяжку выпари-вают до сухого остатка. Затем к остатку добавляют серную или фосфорную кислоту. Далее уксусную кислоту перегоняют с водяным паром. Полученный дистиллят исследуют на ацетат-ион. Методы качественного обнаружения Реакция с хлоридом железа (III) В пробирку вносят 2-3 мл дистиллята и прибавляют 1 каплю свежеприготовленного 5 % раствора хлорида железа (III). Появление красного окрашивания (основной ацетат железа) свидетельствует о наличии в дестилляте ацетат-ионов. Оценка. Предел обнаружения составляет 1,25 мг ацетат-ионов в 1 мл дистиллята. Реакция образования индиго ½ часть дистиллята выпаривают досуха, остаток переносят в пробирку, добавляют смесь оксида и карбоната кальция (1:1). Отверстие пробирки закрывают фильтровальной бумагой, смоченной раствором о-нитробензальдегида в 5 % растворе гидроксида натрия. Пробирку нагревают. Образующийся ацетон улавливают бумагой с нанесенным реактивом. При наличии в исходном дистилляте ацетат-ионов окраска бумаги меняется из желтой в синюю. Ацетон в присутствии щелочи взаимодействует с о-нитробензальдеги-дом через ряд промежуточных продуктов, образуя в конечном итоге индиго.




| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- При повышении температуры на 60ºС скорость реакции увеличилась в 4000 раз
- Подберите по два уравнения в молекулярном виде к каждому из кратких ионных уравнений: а) Fe 2H2O (Fe(OH) 2 ) 2H 3 б) СO H2O HCO3 OH 2 3 в) NH4 H2O NH4OH H
- Ток силой 0,2 А пропускается 300 с через раствор H2SO4.
- Напишите реакции образования всех солей, образовавшиеся при взаимодействии гидроксида железа (III) c ортофосфорной кислотой
- Методом электронного баланса и методом полуреакций (электронноионного баланса) расставить коэффициенты в уравнении реакции, указать окислитель и восстановитель
- Какие соли образуются в результате неполного замещения атомов водорода в молекулах многоосновных кислот атомами металлов?
- Назовите атомы d-элементов, у которых наблюдается провал s-электронов на d-подуровень.
- Почему едкие щелочи необходимо хранить в хорошо закупоренной посуде?
- Напишите формулы мицелл золей иодида серебра, полученного при взаимодействии разбавленных растворов AgNO3 и KI при условиях: а) KI в избытке; б) KI в недостатке
- Написать электронные формулы атомов азота и серы.
