| 🎓 Заказ №: 22205 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Сформулируйте основные положения теории валентных связей. Укажите число локализованных электронных пар центрального атома и механизм их образования в следующих молекулах и ионах: BeH2, NH4 + , BH4 — .
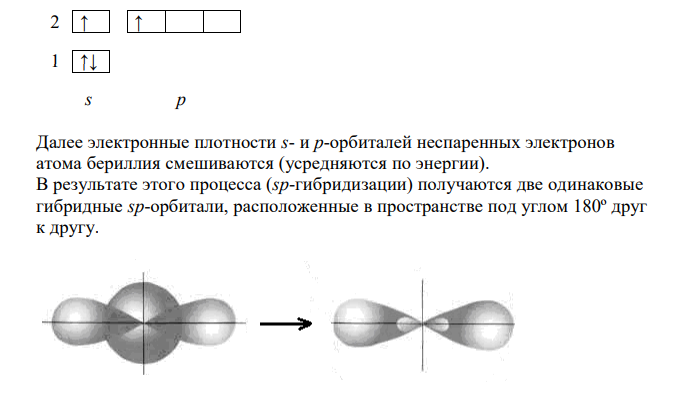
Решение: Основные положения теории валентных связей: 1. Химическая связь между двумя атомами возникает как результат перекрывания атомных орбиталей (АО) с образованием электронных пар (обобществление двух электронов). 2. Атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц. 3. В соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами. 4. Характеристики химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО. Согласно теории валентных связей, ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов. Электронная структура молекулы значительно отличается от электронной структуры образующих ее атомов. Изменения претерпевает электронная структура внешних оболочек и подоболочек атомов, которая в основном и определяет природу и свойства атомов. Поэтому в образовавшейся молекуле атомы с исходной электронной структурой не существуют. У атомов в молекуле сохраняются лишь электронные конфигурации внутренних электронных оболочек, не перекрывающихся при образовании связей. Электронная конфигурация атома бериллия 2 2 Be 1s 2s 2 ↑↓ 1 ↑↓ s p Перед образованием связей атом бериллия переходит в возбужденное состояние, один из 2s-электронов атом бериллия перескакивает на 2p-орбиталь. Таким образом, у атома бериллия появляются два неспаренных электрона. 2 1 1 Be 1s 2s 2 p 2 ↑ ↑ 1 ↑↓ s p Далее электронные плотности s- и p-орбиталей неспаренных электронов атома бериллия смешиваются (усредняются по энергии). В результате этого процесса (sp-гибридизации) получаются две одинаковые гибридные sp-орбитали, расположенные в пространстве под углом 180º друг к другу


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Какие объемы 0,1 и 1,5 М растворов KOH нужно взять для приготовления 280 мл 0,5 М раствора щелочи?
- Произведение растворимости хлорида серебра AgCl равно 1,4∙10-4 при 100 ºС.
- Среднее значение рН внеклеточной среды 7,4, а внутриклеточной – 6,9.
- Гидратацией алкена синтезируйте пропанол-1, из которого затем получите галогенопроизводное.
- Можно ли при стандартных условиях окислить в щелочной среде 2 Fe в 3 Fe с помощью хромата калия K2CrO4 , если B Fe Fe 0,771 0 3 2 ; B CrO Cr OH 0,21 0 [ ( ) ] 3 6 2 4
- В 500 мл насыщенного при некоторой температуре раствора PbF2 содержится 245 мг растворенного вещества.
- Можно ли использовать при стандартных условиях приведенную реакцию для получения аммиака: NH Clк NaOHк NaClк H Oг NH г 4 2 3 ?
- Напишите формулы коллоидной частицы и мицеллы золей, полученных при постепенном приливании к водному раствору первой соли разбавленного раствора второй соли.
- Составьте электронные формулы 16 и 24 элементов.
- Сколько см3 20%-го раствора азотной кислоты плотностью 1,115 см3 , потребуется для нейтрализации раствора, содержащего 16 г гидроксида натрия ?
