| 🎓 Заказ №: 22216 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Реакции выражаются схемами: 87 а) K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl +H2O; б) Au + HNO3 + HCl → AuCl3 + NO + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
Решение a) K Cr O H Cl Cl Cr Cl3 KCl H2O 0 3 2 1 7 6 2 2 В ходе данной окислительно-восстановительной реакции степень окисления хлора повышается от -1 до 0, а хрома понижается от +6 до +3. 0 2 1 2Cl 2e Cl 3 окисление HCl – восстановитель 5 3 3 Cr e Cr 2 восстановление K2Cr2O7 – окислитель K2Cr2O7 6HCl 3Cl2 2CrCl3 KCl H2O В правой части 1 атом калия, в левой части 2 атома калия. Для уравнивания ставим перед формулой KCl коэффициент 2. K2Cr2O7 6HCl 3Cl2 2CrCl3 2KCl H2O В правой части 14 атомов хлора, в левой части 6 атомов хлора. Для уравнивания ставим перед формулой HCl коэффициент 14. K2Cr2O7 14HCl 3Cl2 2CrCl3 2KCl H2O
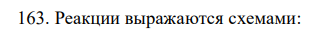


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Вычислить рН буферных растворов, полученных при сливании растворов: а) 60 см3 0,01 М CH3COOH и 40 см3 0,05 М CH3COOK. б) 70 см3 0,01 М NH4Cl и 30 см3 0,05 М NH4OH.
- Напишите уравнение реакции взаимодействия, подберите коэффициенты методом электронно-ионного баланса в окислительно-восстановительной реакции между иодидом калия и пероксидом водорода, если при этом образуются молекулярный йод и едкое кали.
- К растворам NH4OH, K2S, Pb(NO3)2, NaNO3 (к каждому в отдельности) прибавили соляной кислоты.
- Как изменяются свойства элементов с увеличением порядкового номера в периодах и главных подгруппах периодической системы ?
- Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению: PCl5(г) = PCl3(г) + Cl2(г), ΔH = 96,2 кДж/моль
- Чему равен эквивалент воды при взаимодействии ее: а) с натрием; б) с оксидом натрия.
- Реакция протекает по уравнению АВ ↔ А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ.
- Какую массу мочевины можно получить из 1 кг аммиака?
- Напишите выражение для константы равновесия гомогенной системы CH4 + CO2 ↔ 2CO + 2H2.
- Напишите уравнения ступенчатой диссоциации ортофосфорной кислоты.
