| 🎓 Заказ №: 22193 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Парацетамол (ГФ XII, ФС 42-0268-07), с.83 1. Растворимость в спирте. 2. Реакции на подлинность с железа (III) хлоридом. 3. Испытание на чистоту: сульфаты, тяжелые металлы в сульфатной золе. 4. Количественное определение, применение.
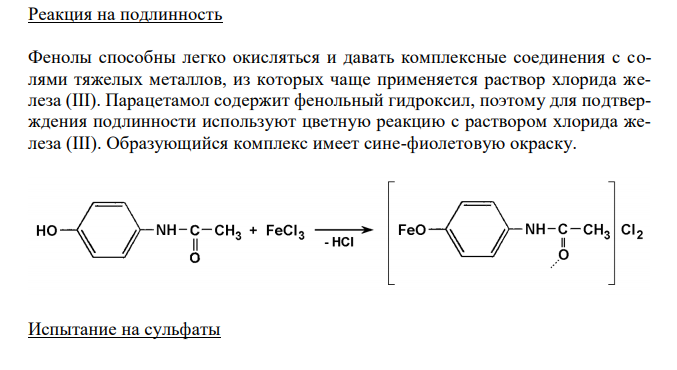
Решение: Парацетамол, Paracetamol Растворимость в спирте Растворимость веществ согласно ОФС 42-0049-07 выражается в условных терминах. Условный термин соответствует определенному интервалу объемов растворителя (мл), в пределах которого должно происходить полное растворение 1 г препарата. ОФС 42-0049-07 допускает следующие условные термины: «очень легко растворим», «легко растворим», «растворим», «умеренно растворим», «мало растворим», «очень мало растворим», «практически нерастворим». Согласно ФС 42-0268-07, парацетамол легко растворим в спирте 96 %. То есть, для растворения 1 г препарата необходим объем спирта 96 % от 1 до 10 мл. Для подтверждения подлинности и доброкачественности навеску предварительно растертого парацетамола массой 1,00 г вносят в 1 мл спирта 96 % и непрерывно встряхивают в течение 10 мин при 20 ± 2°С. Препарат считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. В случае неполного растворения препарата постепенно небольшими порциями прибавляют спирт 96 % (до объема 10 мл) при непрерывном встряхивании. Если навеска полностью растворится в объеме спирта 96 % от 1 до 10 мл, то делают вывод о доброкачественности препарата. Реакция на подлинность Фенолы способны легко окисляться и давать комплексные соединения с солями тяжелых металлов, из которых чаще применяется раствор хлорида железа (III). Парацетамол содержит фенольный гидроксил, поэтому для подтверждения подлинности используют цветную реакцию с раствором хлорида железа (III). Образующийся комплекс имеет сине-фиолетовую окраску. Испытание на сульфаты 141 Сульфаты относятся к общей недопустимой примеси. Наличие в препарате сульфатов определяют по реакции с ионами бария (по образованию сульфата бария). 4 2 2 SO4 Ba BaSO Растворы сульфатов в зависимости от их концентрации образуют с растворами солей бария белый осадок или муть, не исчезающие от прибавления кислоты хлористоводородной разведенной. Вначале готовят эталонный раствор, содержащий 0,01 мг сульфат-иона в 1 мл. 1,814 г сульфата калия, высушенного при температуре от 100 С до 105 С до постоянной массы, растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора до метки водой (раствор А). 10 мл раствора А пипеткой помещают в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки (раствор Б). Эталон готовится смешиванием 10 мл эталонного раствора Б, 0,5 мл кислоты хлористоводородной разведенной и 1 мл раствора хлорида бария. Одновременно готовят испытуемый раствор парацетамола. 0,5 г субстанции парацетамола встряхивают в течение 2 мин с 25 мл воды и фильтруют. После перемешивания по 10 мл испытуемого раствора и эталона помещают в пробирки из прозрачного бесцветного стекла, с внутренним диаметром около 15 мм. Через 10 мин проводят сравнение растворов на чёрном фоне при освещении электрической лампой матового стекла мощностью 40 Вт при вертикальном расположении пробирок. Препарат считают доброкачественным, если испытуемый раствор кальция глюконата, при рассматривании невооружённым глазом, выдерживает сравнение с эталоном (не превышает по мутности).




| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Определите массовую долю хлорида натрия в растворе, полученном при смешении 20 г раствора с массовой долей NaCl 35 % и 300 г раствора с массовой долей NaCl 25 %.
- Вычислите значения G298 для реакции: 2 ( ) ( ) 2 ( ) 2 2 CO г O г CO г
- Выведите формулы следующих изомеров: а) диметилбензола; б) метилэтилбензола; в) этилизопропилбензолов.
- Имеется раствор слабого электролита или электролита средней силы (см. вариант в табл. 7).
- Для данной реакции подберите коэффициенты методом электронного баланса.
- Выведите все изомерные алкины состава: а) C5H8; б) C4H6.
- Используя упрощенные структурные формулы, выведите все изомерные углеводороды состава: а) С5Н10 (пять изомеров); б) С4Н8 (три изомера).
- Рассчитайте температуру кипения и замерзания раствора, состав которого представлен в табл.8 Температура кипения и кристаллизации, криоскопическая и эбуллиоскопиическая постоянные чистых растворителей приведены в приложении 4.
- Выведите формулы изомерных спиртов С4Н10О (4 изомера).
- Методом электронно-ионного баланса подберите коэффициенты окислительно-восстановительной реакции: KMnO4 Na2 SO3 H2 SO4 MnSO4 Na2 SO4 H2O K2 SO4
