| 🎓 Заказ №: 22193 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Охарактеризуйте электронное строение атома углерода в основном и возбужденном состояниях. Перечислите виды гибридизации атома углерода в органических молекулах, объясните в каждом случае форму и пространственную направленность атомных орбиталей. Дайте определение σ- и π-свя-зям, индуктивному и мезомерному эффектам. Рассмотрите передачу электронного влияния заместителей на примере: а) 2- пентена, б) бензальдегида, в) фенола.
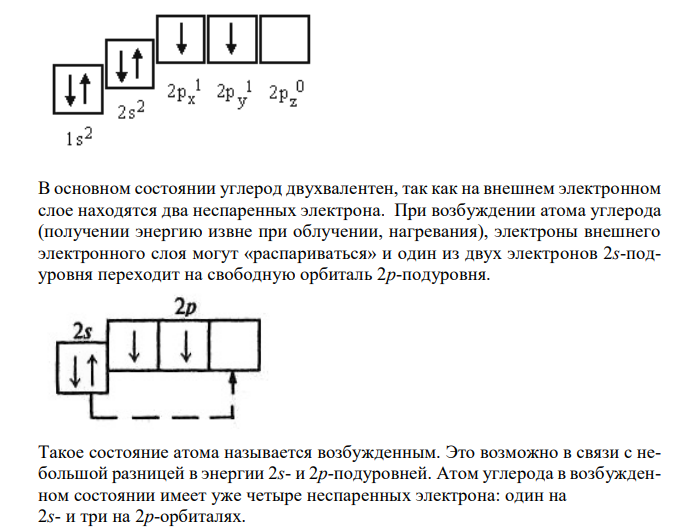
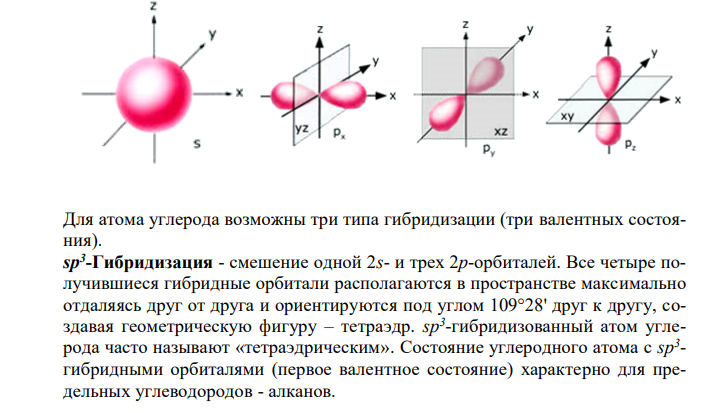
Решение: В периодической системе элементов Д.И. Менделеева углерод расположен в главной подгруппе IV группы, его порядковый номер 6. Электронная структура (конфигурация) атома углерода в основном (невозбужденном) состоянии имеет вид 1s 22s 22p 2 Расположение электронов по орбиталям в основном состоянии можно изобразить следующим образом В основном состоянии углерод двухвалентен, так как на внешнем электронном слое находятся два неспаренных электрона. При возбуждении атома углерода (получении энергию извне при облучении, нагревания), электроны внешнего электронного слоя могут «распариваться» и один из двух электронов 2s-подуровня переходит на свободную орбиталь 2p-подуровня. Такое состояние атома называется возбужденным. Это возможно в связи с небольшой разницей в энергии 2s- и 2p-подуровней. Атом углерода в возбужденном состоянии имеет уже четыре неспаренных электрона: один на 2s- и три на 2p-орбиталях. Расположение электронов по орбиталям в возбужденном состоянии можно изобразить следующим образом Четыре валентности атома углерода равноценны. Перед образованием связей происходит смешение смешения орбиталей и образование новых (гибридных орбиталей) равноценных по энергии. s-орбиталь имеет сферическую форму, а р-орбиталь — форму объемной восьмерки, определенным образом ориентированной в пространстве. Для атома углерода возможны три типа гибридизации (три валентных состояния). sр3 -Гибридизация — смешение одной 2s- и трех 2р-орбиталей. Все четыре получившиеся гибридные орбитали располагаются в пространстве максимально отдаляясь друг от друга и ориентируются под углом 109°28′ друг к другу, создавая геометрическую фигуру – тетраэдр. sp3 -гибридизованный атом углерода часто называют «тетраэдрическим». Состояние углеродного атома с sp3 — гибридными орбиталями (первое валентное состояние) характерно для предельных углеводородов — алканов.


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Дайте обоснование ацидиметрическому методу количественного определения натрия тетрабората (ГФ XII, ч. 3, ФС 42 -, см. приложение с. 63).
- Константа равновесия реакции N2 + 3H2 ↔ 2NH3 равна 0,1 (при температуре 400 °С).
- На основании электронных уравнений расставьте коэффициенты в уравнениях реакций; укажите окислитель и восстановитель: S KOH K2 S K2 SO3 H2O KMnO4 K2MnO4 MnO2 O2
- Какие из солей подвергаются гидролизу Na2SO3, LiI, AlBr3, CH3COOK?
- Определите, какие из солей подвергаются гидролизу?
- Вычислите rG (298 К) и определите возможность осуществления в стандартных условиях реакции N2O(г) + 0,5O2(г) = 2NO(г).
- Укажите значение органической химии в системе фармацевтического образования.
- В каких единицах определяется скорость химических реакций ?
- Какие из веществ – NaCl, Ni(OH)2, Be(OH)2, KHCO3 – взаимодействуют с раствором гидроксида натрия?
- Гальванический элемент состоит из цинка, погруженного в 0,1 М Zn(NO3)2 и водородного электрода с рН = 1.
