| 🎓 Заказ №: 22216 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 203 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Определите тип гибридизации и укажите геометрическую структуру молекул
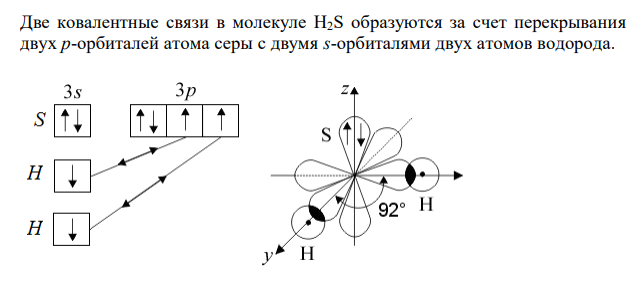
Решение: Электронная формула атома водорода 1 1H 1s Электронно-графическая формула атома водорода Электронная формула атома серы 2 2 6 2 4 16 S 1s 2s 2p 3s 3p Электронно-графическая формула внешнего уровня атома серы Две ковалентные связи в молекуле H2S образуются за счет перекрывания двух р-орбиталей атома серы с двумя s-орбиталями двух атомов водорода. Пространственная ориентация р-орбиталей – вдоль трех осей, находящихся под углом 90º друг к другу. Молекула H2S имеет угловую структуру. Из-за отталкивания электронных облаков связей S-H, угол H-S-H составляет больше, чем 90º (92º). Гибридизации не происходит. Электронная формула атома фтора 2 2 5 9 F 1s 2s 2p Электронно-графическая формула атома фтора Электронная формула атома теллура 2 2 6 2 6 2 10 6 2 10 4 52Te 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p Электронно-графическая формула атома теллура Перед образованием молекулы TeF6 атом теллура переходит во второе возбужденное состояние: происходит распаривание вначале пары 5p-электронов, затем пары 5s-электронов атома теллура с переходом одного электрона из каждой пары на вакантные орбитали 4d-подуровня.




| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Напишите 4 уравнения реакции получения соли BaCO3 (в ионном виде)
- Расположить в ряд по убыванию основных свойств следующие соединения; сделать соответствующие выводы: Pb(OH)2 – Ka = 2·10 –16; KB 1 = 9,6·10–4 ; KB 2 = 3·10–4 Al(OH)3 – Ka = 4·10–13 ; KB = 8·10–25 Zn(OH)2 – Ka 1 = 7,1·10–12; Ka 2 = 2·10–13; KB 1 = 1,5·10–9 Cr(OH)3 – Ka = 9·10–14 ; KB = 9·10–19
- Объясните аллостерическую регуляцию активности ферментов и механизм саморегуляции метаболизма на клеточном уровне на примере распада углеводов.
- Напишите формулу витамина PP, укажите пищевые источники, признаки авитаминоза и коферментные функции витамина (НАД). Напишите химическую реакцию восстановления НАД.
- Какие катионы можно определить, используя вариант прямого комплексонометрического титрования?
- Дайте характеристику основных биохимических функций печени.
- Вычислить концентрацию ионов меди(II) в растворе, в 1 дм3 которого содержалось 0,2 моль ионов меди(II) и 1 моль аммиака?
- Вычислите процентную концентрацию 8 М раствора HNO3 (плотность равна 1,25 г/см3 ).
- Составьте 4 уравнения реакции (в ионном виде) получения гидроксида меди
- В задачах (1-20) составить уравнения реакций, с помощью которых можно осуществить следующие превращения: UO3 → UO2Cl2 → Na2UO4 → Na(HUO4)
