| 🎓 Заказ №: 22206 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
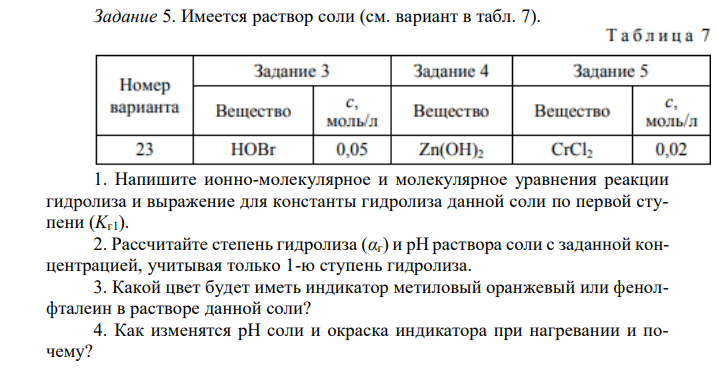
Имеется раствор соли (см. вариант в табл. 7). 1. Напишите ионно-молекулярное и молекулярное уравнения реакции гидролиза и выражение для константы гидролиза данной соли по первой ступени (Kг1). 2. Рассчитайте степень гидролиза (αг) и рН раствора соли с заданной концентрацией, учитывая только 1-ю ступень гидролиза. 3. Какой цвет будет иметь индикатор метиловый оранжевый или фенолфталеин в растворе данной соли? 4. Как изменятся рН соли и окраска индикатора при нагревании и почему?
Решение: 1. Хлорид хрома (II) CrCl2 образован слабым основанием Cr(OH)2 и сильной кислотой HCl. В растворе хлорида хрома (II) гидролиз обусловлен катионами хрома (II) 2 Cr , связывающими гидроксид-анионы. В обычных условиях гидролиз данной соли ограничивается первой ступенью. Ионно-молекулярное уравнение гидролиза Cr H2O CrOH H 2 Молекулярное уравнение гидролиза CrCl H O CrOHCl HCl 2 2 Записываем выражение для константы гидролиза данной соли по первой ступени (Kг1). [ ] [ ][ ] ( ) 2 г1 4 CrCl CrOHCl HCl K ZnSO

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Рассчитайте и укажите степень окисления (CO) атомов эле-ментов в — ClO4 , Cl- , — CrO2 , F2.
- Определите комплексообразователь, его заряд, координационное число в следующих комплексных соединениях: а) [Pt(NH ) Cl ]Cl 3 2 3 б) 2 5 2 [Cr(H O) Cl]Cl в) [ ( ) ( ) ]
- Покажите отношение Zn, Cd и Hg к растворам кислот и щелочей
- Для гальванического элемента 107 Zn / Zn(NO3)2, 0,001 M // Zn(NO3)2 / Zn рассчитайте электродные потенциалы и ЭДС.
- Напишите уравнения реакций электролитической диссоциации следующих электролитов: 19 – уксусной кислоты
- Напишите молекулярные и ионные реакции обмена, имея в виду, что образующиеся комплексные соли в воде нерастворимы: K3[Fe(CN)6]+AgNO3
- Дано уравнение реакции (см. вариант в табл 4).
- Определите концентрации ионов (моль/л) в водных растворах следующих сильных электролитов: 19 – 0,04 M нитрата калия.
- Определите молярную концентрацию сульфата железа (III) в 24 % растворе плотностью 1,29 г/см3 .
- Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4).
