| 🎓 Заказ №: 22228 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
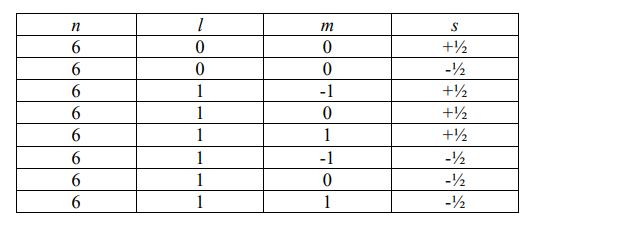
Дано значение одного из четырех квантовых чисел (n = 6). Составьте таблицу значений четырех квантовых чисел: n, l, m, s.
Решение: Имеется четыре квантовых числа. n – главное квантовое число, характеризующее общий запас энергии (соответствует числу электронных слоев и номеру периода), может принимать положительные целочисленные значения : 1, 2, 3, и т.д. Орбитальное квантовое число характеризует форму электронного облака (орбитали). При = 0 орбитали имеют форму сферы, при = 1 форму гантелей (объемные «восьмерки»), d-орбитали ( = 2) имеют форму четырехлепестко-вых розеток, каждая из которых образована двумя гантелями, либо гантели с тором в экваториальной плоскости. l принимает значения от 0 до n (при n=0 орбитальное квантовое число также равно 0). Магнитное квантовое число m характеризует пространственную ориентацию электронных облаков и может принимать значения от – до + , включая ноль. Общее количество значений равно 2 + 1. s — спиновое квантовое число, принимает значения – ½ или + ½ . Теоретически, при n = 6 квантовое число l может принимать значения от 0 до 6. На данный момент известны химические элементы, для которых l равно от 0 до 3. Составляем таблицу всех теоретически возможных сочетаний квантовых чи-сел при n = 6. n l m s 6 0 0 +½ 6 0 0 -½ 6 1 -1 +½ 6 1 0 +½ 6 1 1 +½ 6 1 -1 -½ 6 1 0 -½ 6 1 1 -½

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Исходя из степени окисления хлора, определите, какое из соединений: Cl2, HCl, HClO4 – только окислитель, только восстановитель и какое из них может иметь функцию и окислителя и восстановителя.
- Какое значение рН (> 7 <) имеют растворы солей Na3PO4, K2S, CuSO4?
- Расставьте коэффициенты методом электронного баланса, проставить сте-пени окисления химических элементов, указать окислитель и восстановитель. HgS HNO3 HCl HgCl2 S NO H2O
- Классифицируйте и назовите следующие соли: MgSO4, (СuОН)2SО4, KH2SbO4, Ba(HS)2, NiOHNO3, CrPO4, Mn(NO3)2.
- Каковы типы связей в соединениях: СНСl3, CO, NiCl2, H2SiO3, KOH?
- Вычислить ΔrG 0 для реакции N2 + O2= 2NO при 1000, 2000, 3000, 5000 и 10000 С; построить график зависимости ΔrG от Т и найти по графику температуру, выше которой эта реакция может протекать самопроизвольно.
- Какие из веществ – NaCl, NiSO4, Be(OH)2, KHCO3 – взаимодействуют с раствором гидроксида натрия ?
- Определить формулу вещества, содержащего 1,22 массов. части калия, 1,11 массов. части хлора и 2,00 массов. части кислорода.
- Константа равновесия реакции Н2 (г) + I2 (г) ⇄ 2HI (г) равна 0,1.
- Составьте ионное и молекулярное уравнения гидролиза NH4Cl.
