Оглавление:
Водородный показатель. Произведение растворимости. Гидролиз солей
Пример 79
Каково значение pH раствора, концентрация ионов 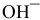 которого равна
которого равна 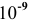 моль/л ?
моль/л ?
Решение:
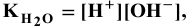
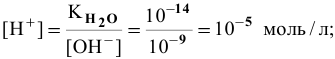
откуда
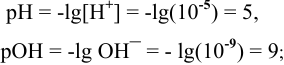
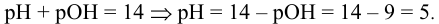
Пример 80
Какова концентрация ионов водорода и ионов гидроксила раствора, pH которого равен 10,3?
Решение:
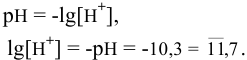
По таблицам логарифмов находим: 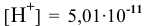 моль/л. Так как
моль/л. Так как 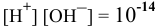 , определяем
, определяем 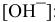 :
:
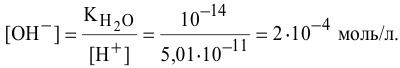
Пример 81
Определить pH растворов сильных электролитов:
а) 0,1 молярного раствора 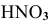 (а = 0,92; f = 0,79);
(а = 0,92; f = 0,79);
б) 0,01 молярного раствора 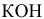 (а = 0,93; f = 0,90).
(а = 0,93; f = 0,90).
Решение:
1) Для 0,1 молярного раствора 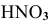 находим:
находим:
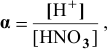
где 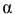 — степень диссоциации;
— степень диссоциации;
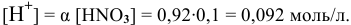
Затем определяем:
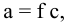
где а — активность, т.е. проявляющаяся концентрация ионов;
с — реальная концентрация;
f — коэффициент активности, для очень разбавленных растворов 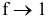 , тогда а ~ с.
, тогда а ~ с.
Активность ионов водорода находим по формуле
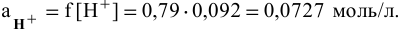
Определяем pH раствора, причем вместо реальной концентрации используем активность:
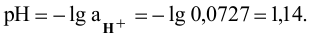
2) Для 0,01 молярного раствора КОН:
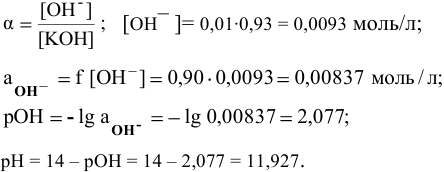
Пример 82
Определить pH 0,6 молярного раствора 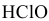
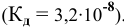
Решение:
Для слабого электролита расчет pH производится по величине константы дисоциации 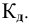 . И так как величины концентраций очень малы, активность
. И так как величины концентраций очень малы, активность 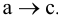
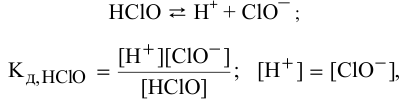
тогда
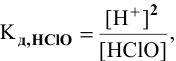
где 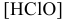 — равновесная концентрация, однако в связи со слабой диссоциацией принимают ее равной общей концентрации молекул кислоты, как диссоциированных, так и недиссоциированных:
— равновесная концентрация, однако в связи со слабой диссоциацией принимают ее равной общей концентрации молекул кислоты, как диссоциированных, так и недиссоциированных:
Задача № 2. Расчеты по произведению растворимости.
Пример 83
Рассчитать произведение растворимости 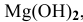 , если его растворимость равна
, если его растворимость равна 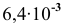 г/л.
г/л.
Решение:
Для выражения растворимости малорастворимых веществ чаще всего используются два способа ее выражения.
1. Растворимость в граммах на литр раствора
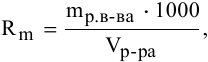
где 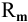 — растворимость вещества, г/л;
— растворимость вещества, г/л;
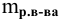 — масса растворенного вещества, г;
— масса растворенного вещества, г;
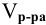
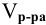 — объем раствора, мл.
— объем раствора, мл.
Тогда концентрация какого-либо иона растворенного вещества определяется по формуле
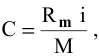
где М — молярная масса растворенного вещества;
i — индекс иона в формуле.
2. Растворимость в молях молекул растворенного вещества на литр раствора
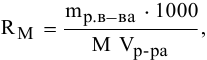
где 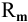 — растворимость, моль/л.
— растворимость, моль/л.
Тогда концентрация какого-либо иона растворенного вещества определяется по формуле
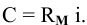
В настоящей задаче растворимость 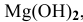 выражена в граммах на литр. Вычислим концентрацию ионов
выражена в граммах на литр. Вычислим концентрацию ионов 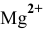 и ионов ОН в насыщенном растворе
и ионов ОН в насыщенном растворе 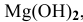 :
:
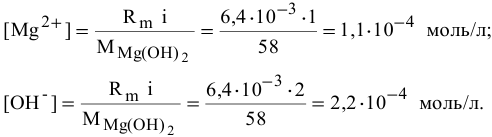
Найдем произведение растворимости 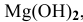 :
:
Пример 84
Определить концентрацию ионов 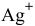 и растворимость
и растворимость 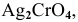 , выраженную в граммах на литр насыщенного раствора
, выраженную в граммах на литр насыщенного раствора 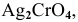
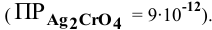
Решение:
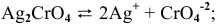
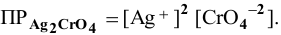
Примем концентрацию 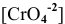 равной X, тогда
равной X, тогда 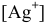 = 2Х, так как диссоциация одной молекулы
= 2Х, так как диссоциация одной молекулы 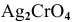 дает один ион
дает один ион 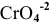 и два иона
и два иона 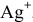 .
.
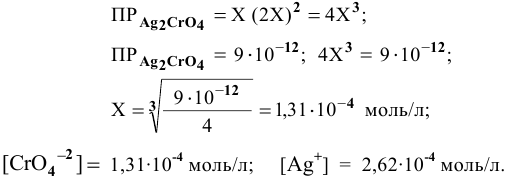
Определим растворимость соли в граммах на литр:
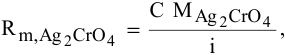
где С — концентрация какого-либо иона;
i — его индекс.
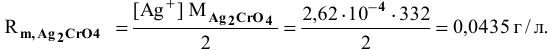
Пример 85
Будет ли наблюдаться осаждение сульфата кальция при смешивании одинаковых объемов 0,002 молярного раствора 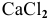 и 0,004 молярного раствора
и 0,004 молярного раствора 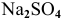 ? Если в этих условиях осаждение не будет наблюдаться, какова должна быть концентрация
? Если в этих условиях осаждение не будет наблюдаться, какова должна быть концентрация 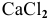 в исходном растворе, чтобы началось осаждение
в исходном растворе, чтобы началось осаждение 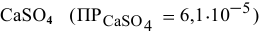 ?
?
Решение:
Условие осаждения осадков следующее:
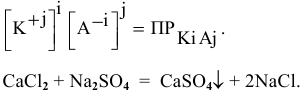
Определяем концентрации ионов 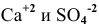 в полученном растворе.
в полученном растворе.
Для упрощения расчетов принимаем 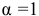 для рассмотренных солей. При смешении одинаковых объемов обоих растворов общий объем полученного раствора удваивается, а значит, первоначальная концентрация растворенных веществ уменьшается вдвое.
для рассмотренных солей. При смешении одинаковых объемов обоих растворов общий объем полученного раствора удваивается, а значит, первоначальная концентрация растворенных веществ уменьшается вдвое.
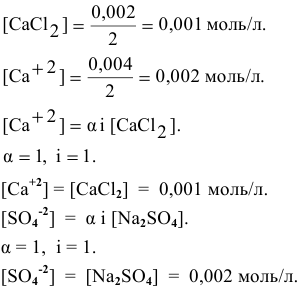
Произведение концентраций ионов 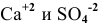
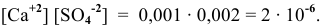
Произведение растворимости 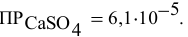
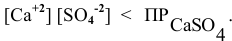
Произведение концентраций ионов ниже, чем произведение растворимости 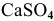 , таким образом, образование осадка наблюдаться не будет.
, таким образом, образование осадка наблюдаться не будет.
Чтобы наблюдалось осаждение должно выполняться следующее условие:

Таким образом, концентрация ионов кальция должна быть выше 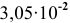 моль/л, а в исходном растворе (до разбавления) она должна быть выше
моль/л, а в исходном растворе (до разбавления) она должна быть выше 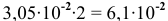 моль/л, чтобы наблюдалось осаждение
моль/л, чтобы наблюдалось осаждение 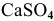 .
.
Пример 86
Что произойдет, если в 1 л насыщенного раствора 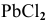
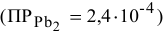
добавить 2 л 3-молярного раствора 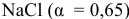 ?
?
Решение:
Определяем, прежде всего, концентрацию ионов 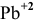 в исходном растворе:
в исходном растворе:
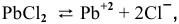
После добавления в исходный раствор 2 л 3-молярного раствора  концентрация ионов свинца уменьшится:
концентрация ионов свинца уменьшится:
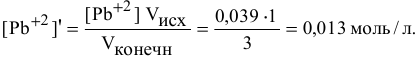
Концентрация 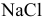 в полученном растворе
в полученном растворе
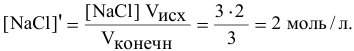
Определяем концентрацию образующихся от диссоциации молекул 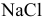 ионов
ионов 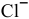 в полученном растворе, пренебрегая концентрацией ионов
в полученном растворе, пренебрегая концентрацией ионов 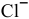 , внесенных
, внесенных 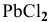 , из-за ее малой величины.
, из-за ее малой величины.
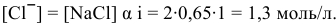
Произведение концентраций 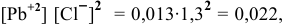 что выше.
что выше.
чем произведение растворимости 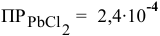 .
.
Таким образом, будет наблюдаться осаждение 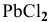 . Теперь можно рассчитать массу полученного осадка
. Теперь можно рассчитать массу полученного осадка 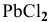 .
.
Для этого определим концентрацию ионов свинца в насыщенном растворе после осаждения 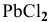 :
:
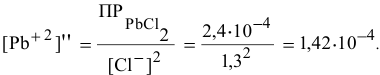
Так как концентрация ионов 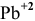 в полученном растворе до осаждения была 0,013 моль/л, то концентрация ионов свинца, образовавших осадок, будет следующей:
в полученном растворе до осаждения была 0,013 моль/л, то концентрация ионов свинца, образовавших осадок, будет следующей:
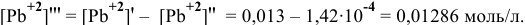
Это соответствует следующей концентрации РЬ, дающей осадок:
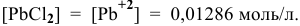
Определяем массу осадка:
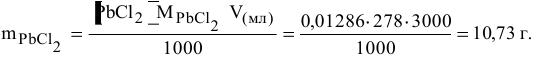
Пример 87
Можно ли полностью осадить ионы 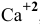 , добавляя
, добавляя 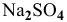 до концентрации ионов
до концентрации ионов 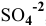 , равной 2 моль/л
, равной 2 моль/л 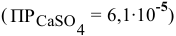 ? Если нет, то какой должна быть концентрация ионов
? Если нет, то какой должна быть концентрация ионов 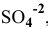 , чтобы осаждение ионов
, чтобы осаждение ионов 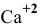 было полным?
было полным?
Решение:
В аналитической химии принято считать полным осаждение ионов при их концентрации ниже 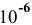 моль/л. Определяем концентрацию ионов в полученном растворе:
моль/л. Определяем концентрацию ионов в полученном растворе:
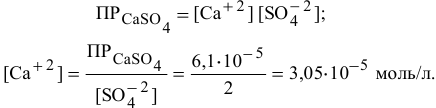
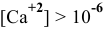 моль/л, а значит, осаждение ионов
моль/л, а значит, осаждение ионов  считается неполным.
считается неполным.
Для полного осаждения ионов  должно выполняться следующее условие:
должно выполняться следующее условие: 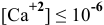 моль/л, тогда
моль/л, тогда
Практически такую концентрацию достичь невозможно.
Таким образом, полностью осадить ионы  ионами
ионами  невозможно.
невозможно.
Пример 88
В каком направлении смещено равновесие следующих ионообменных реакций:
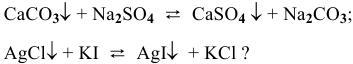
Решение:
Рассмотрим на примере последней реакции.
Равновесие ионообменных реакций с участием малорастворимых веществ смещено в сторону образования вещества с меньшим произведением растворимости.
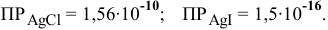
Равновесие данной реакции смещено в сторону образования 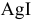 , так как
, так как 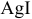 посылает в раствор меньшее число ионов
посылает в раствор меньшее число ионов 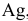 , чем
, чем 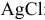 :
:
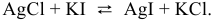
Задача 76.85
Написать молекулярные и ионные уравнения гидролиза следующих солей: 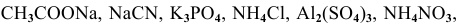
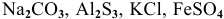 . Указать характер среды водных растворов этих солей.
. Указать характер среды водных растворов этих солей.
Решение:
Вначале определяется природа соли.
Соли, образованные слабым основанием и сильной кислотой и, наоборот, сильным основанием и слабой кислотой, подвергаются частичному гидролизу, в большинстве случаев преимущественно по I ступени, при этом в уравнении гидролиза ставятся две стрелки в противоположных направлениях  , указывающие на незначительное протекание гидролиза.
, указывающие на незначительное протекание гидролиза.
Соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается.
Для написания ионного уравнения гидролиза применяют те же правила, что и при написании ионных уравнений любых ионообменных реакций: мало-диссоциируемые молекулы или ионы записывают в неизменном виде, тогда как молекулы сильных электролитов записывают в виде ионов.
1. 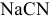 — соль, образованная сильным основанием и слабой кислотой:
— соль, образованная сильным основанием и слабой кислотой:
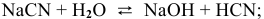
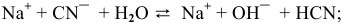
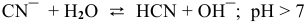 , среда щелочная.
, среда щелочная.
2. 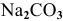 — соль, образованная сильным основанием и слабой двухосновной кислотой.
— соль, образованная сильным основанием и слабой двухосновной кислотой.
Гидролиз протекает преимущественно по I ступени:
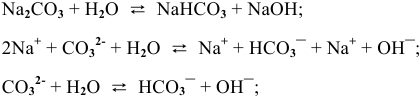
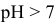 , среда щелочная.
, среда щелочная.
По II ступени гидролиз практически не протекает, равновесие сильно смещено влево:
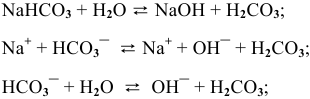
pH > 7, среда слабощелочная.
3. 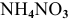 — соль, образованная сильной кислотой и слабым основанием:
— соль, образованная сильной кислотой и слабым основанием:
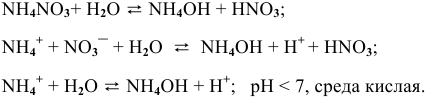
4.  — соль, образованная сильной кислотой и слабым двухкислотным основанием.
— соль, образованная сильной кислотой и слабым двухкислотным основанием.
Гидролиз протекает преимущественно по I ступени:
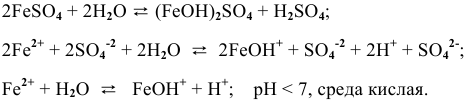
По II ступени гидролиз практически не протекает, равновесие сильно смещено влево:
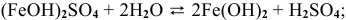
5.  — соль, образованная слабым основанием и слабой кислотой. Подвергается полному гидролизу:
— соль, образованная слабым основанием и слабой кислотой. Подвергается полному гидролизу:
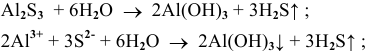
 , среда, близкая к нейтральной.
, среда, близкая к нейтральной.
6. 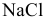 — соль, образованная сильной кислотой и сильным основанием:
— соль, образованная сильной кислотой и сильным основанием:
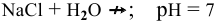 , среда нейтральная.
, среда нейтральная.
Задача 64
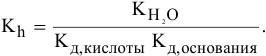
Рассчитать константу гидролиза и pH водных растворов следующих солей:

Решение:
1) Для соли, образованной слабой кислотой и сильным основанием,
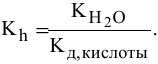
Находим в справочнике:
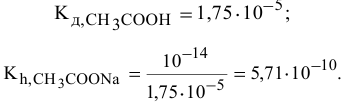
Выражение константы гидролиза:
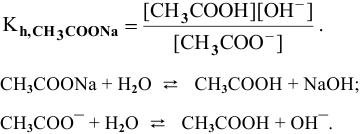
Так как 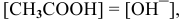 , то
, то
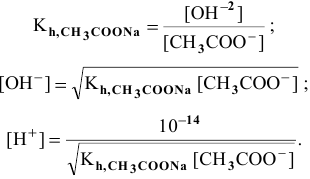
Предположив, что соль 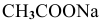 диссоциирует полностью, вместо
диссоциирует полностью, вместо 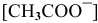 подставляем
подставляем 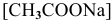 :
:
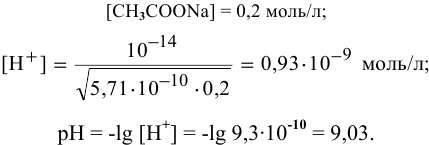
2) Для соли, образованной сильной кислотой и слабым основанием,
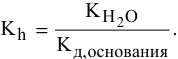
Находим в справочнике:
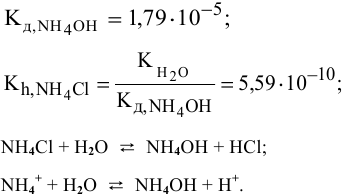
Выражение константы гидролиза имеет вид
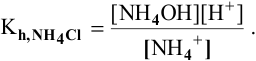
Так как 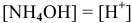 , то
, то
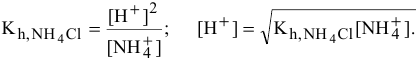
Предположив, что соль  диссоциирует полностью, вместо
диссоциирует полностью, вместо 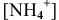 подставляем [
подставляем [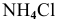 ]:
]:
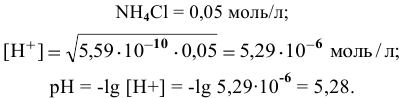
3) Для соли, образованной слабым основанием и слабой кислотой,
Находим в справочнике:
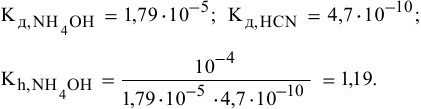
Химическое равновесие смещено в сторону продуктов гидролиза.
Характер среды слабощелочной, так как  образуются в равном количестве, причем сила
образуются в равном количестве, причем сила  намного больше, чем HCN:
намного больше, чем HCN:
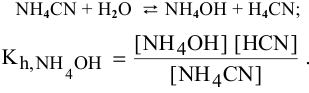
Рассчитаем концентрацию 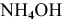 в состоянии равновесия.
в состоянии равновесия.
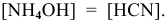
В начальный момент концентрации следующие:
В состоянии равновесия:
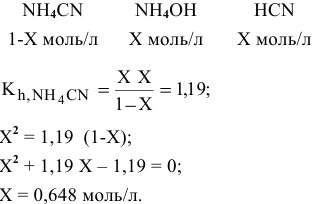
В состоянии равновесия концентрации следующие:
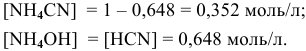
Производим расчет pH, используя выражение константы диссоциации 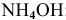
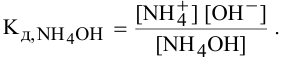
Предположив, что 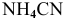 диссоциирует полностью, вместо
диссоциирует полностью, вместо 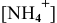 подставляем концентрацию
подставляем концентрацию 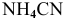 , так как количество ионов, полученных при диссоциации
, так как количество ионов, полученных при диссоциации 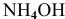 , ничтожно мало по сравнению с количеством ионов
, ничтожно мало по сравнению с количеством ионов 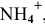 ,
,
полученных при диссоциации 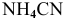 :
:
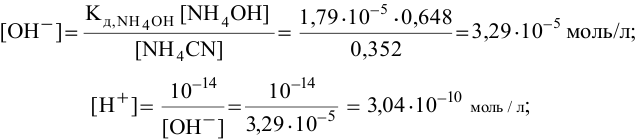
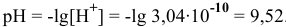 . Среда слабощелочная.
. Среда слабощелочная.
Задача 65
Написать уравнение совместного гидролиза двух солей: 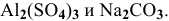 .
.
Решение:
Так как данные соли противоположного типа — 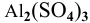 образована слабым основанием и сильной кислотой, a
образована слабым основанием и сильной кислотой, a 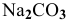 образована сильным основанием и слабой кислотой, то при растворении в воде они дают разную реакцию растворов:
образована сильным основанием и слабой кислотой, то при растворении в воде они дают разную реакцию растворов:
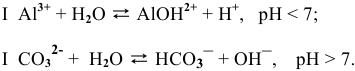
При сливании растворов происходит взаимная нейтрализация:
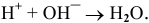
Это смещает оба равновесия вправо, и становятся возможными следующие стадии гидролиза:
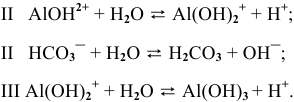
В итоге происходит полный гидролиз:
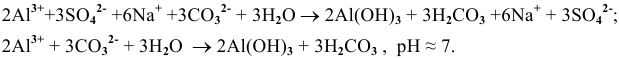
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

