Оглавление:
Термохимические и термодинамические расчеты
Пример 47
Рассчитать энергетический эффект химической реакции в стандартных условиях: 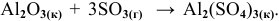 Известны энтальпии образования участвующих в реакции соединений:
Известны энтальпии образования участвующих в реакции соединений:
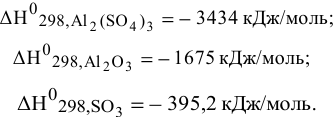
Решение:
Энтальпия этой реакции рассчитывается по формуле
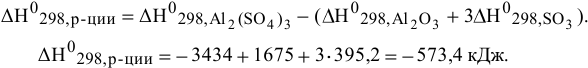
Энтальпия системы в ходе реакции уменьшается, в этом случае энергия выделяется, реакция экзотермическая.
Пример 48
Рассчитать энтальпию реакции
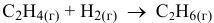
в стандартных условиях, зная энтальпии сгорания участвующих в реакции веществ:
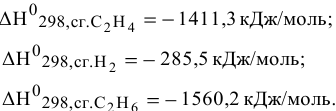
Энтальпии реакции можно рассчитать по формулам:
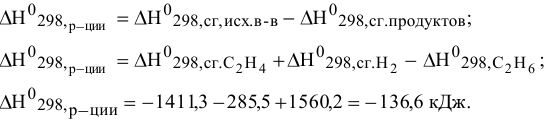
Данная реакция экзотермична.
Пример 49
Определить энтальпию образования метана, зная, что энтальпия реакции горения метана 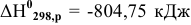 , а стандартные значения энтальпий образования
, а стандартные значения энтальпий образования 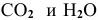 равны соответственно -396 кДж/моль и -241,8 кДж/моль.
равны соответственно -396 кДж/моль и -241,8 кДж/моль.
Решение:
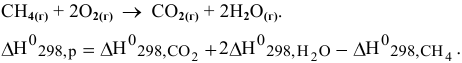
Отсюда
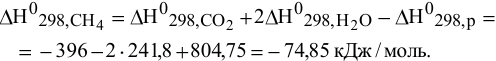
Пример 50
Какое количество тепла выделяется в ходе горения 10 г серы, если стандартное значение энтальпии образования 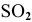 равно -296,9 кДж/моль?
равно -296,9 кДж/моль?
Решение:
Уравнение химической реакции горения серы —
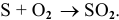
Энтальпия этой реакции определяется по формуле
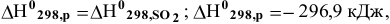
реакция экзотермическая.
Определяем количество тепла, выделенное при горении 10 г серы.
Согласно уравнению реакции 1 моль дает 296,9 кДж тепла. Составляем пропорцию:
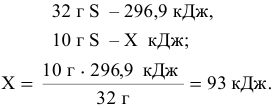
Задача № 2. Расчет энергии связи по энтальпии.
Пример 51
Определить энергию связи О-Н в молекуле воды, зная стандартное значение энтальпии образования воды в газообразном состоянии, равное -241,6 кДж/моль, и энергии связи в молекуле кислорода и в молекуле водорода.

Решение:
Уравнение реакции образования воды —
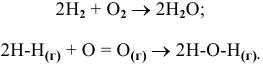
Известно, что для реакции с участием всех веществ в газообразном состоянии энтальпия может определяться по следующей формуле:
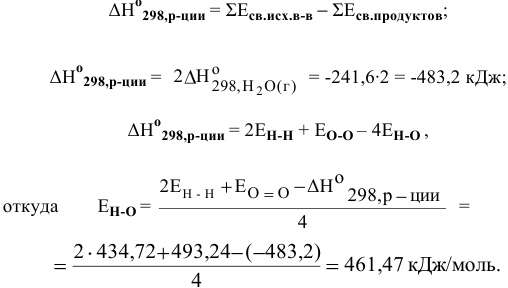
Задача № 3. Расчет энтальпии гидратации.
Пример 52
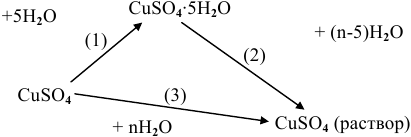
Известны энтальпии растворения безводного сульфата меди (-66,46 кДж/моль) и кристаллогидрата 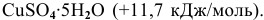 Определить энтальпию гидратации
Определить энтальпию гидратации 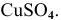
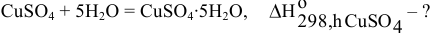
Решение:
Реакция гидратации может быть представлена как алгебраическая разность двух реакций:
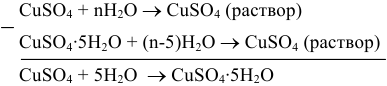
или в виде следующей схемы:
Согласно закону Гесса
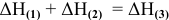
или
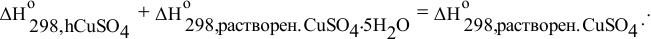
Отсюда
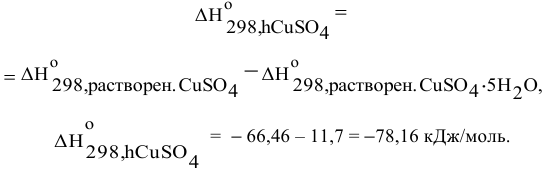
Задача № 4. Расчет энтропии реакции.
Пример 53
Определить изменение энтропии системы в ходе следующей реакции:
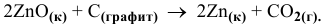
Стандартные значения энтропий, участвующих в реакции веществ, следующие:
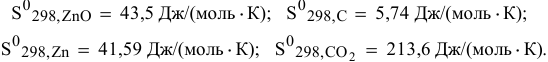
Решение:
Рассчитаем энтропию реакции по формуле
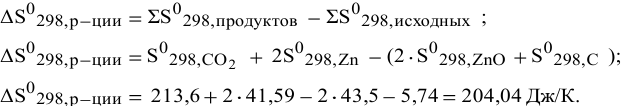
Задача № 5. Расчет изобарно-изотермического потенциала (энергии Гиббса) реакции.
Пример 54
Определить изменение изобарно-изотермического потенциала системы в стандартных условиях в ходе следующей реакции:
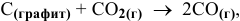
если изменение энтальпии системы в ходе этой реакции 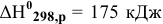 а изменение энтропии
а изменение энтропии 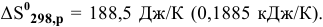 . Возможна ли данная реакция в стандартных условиях? Каков ее характер?
. Возможна ли данная реакция в стандартных условиях? Каков ее характер?
Решение:
Подставим значения 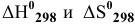 в уравнение Гиббса:
в уравнение Гиббса:
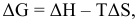
если Т = 298 К, тогда
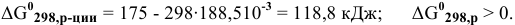
В стандартных условиях эта реакция термодинамически невозможна.
Чтобы ответить на вопрос, каков характер этой реакции и возможна ли она в каких-либо условиях, отличающихся от стандартных, необходимо изучить знаки 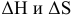 этой реакции (табл.5).
этой реакции (табл.5).
Таким образом, исследуемая реакция, знаки 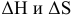 которой положительны, обратимая. Высокие температуры способствуют протеканию этой реакции в прямом направлении. Реакция, являясь невозможной в стандартных условиях, становится возможной при определенных высоких температурах.
которой положительны, обратимая. Высокие температуры способствуют протеканию этой реакции в прямом направлении. Реакция, являясь невозможной в стандартных условиях, становится возможной при определенных высоких температурах.
Таблица 5
Характер реакции в зависимости от значений 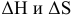 реакции
реакции

Пример 55
Определить энергию Гиббса реакции:
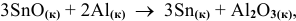
зная значения стандартных изобарно-изотермических потенциалов веществ, участвующих в реакции:
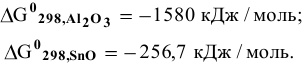
Решение:
Формула для расчета энергии Гиббса (изобарноизотермического потенциала) химической реакции по значениям изобарноизотермических потенциалов, участвующих в реакции веществ,
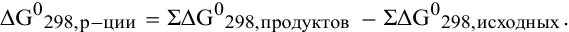
Для изучаемой реакции
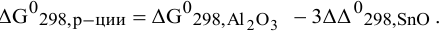
Так как значения изобарно-изотермических потенциалов простых веществ в стандартных условиях приняты равными 0,
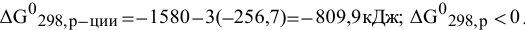
В стандартных условиях реакция термодинамически возможна.
Пример 56
Определить приблизительно, при какой температуре реакция
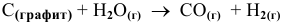
становится термодинамически возможной 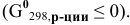
Примечание. Предполагается, что изменение величин 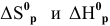 незначительно с изменением температуры, поэтому принимается:
незначительно с изменением температуры, поэтому принимается:
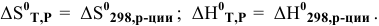
В действительности эти величины неравны, поэтому для более точных расчетов производится определение 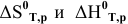 по соответствующим законам.
по соответствующим законам.
Известны следующие величины:

Решение:
Рассчитаем энтропию реакции в стандартных условиях:
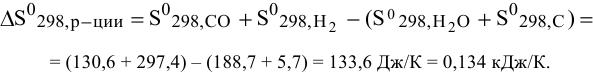
Рассчитываем энтальпию реакции в стандартных условиях:
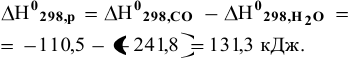
Энергия Гиббса реакции в стандартных условиях:
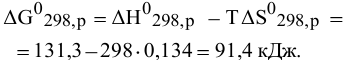
В стандартных условиях изучаемая реакция термодинамически невозможна, однако она обратима, и высокие температуры способствуют протеканию реакции в прямом направлении. Определяем приблизительно температуру, при которой реакция становится термодинамически возможной, при этом принимаем, что термодинамические функции состояния не изменяются при изменении температуры:
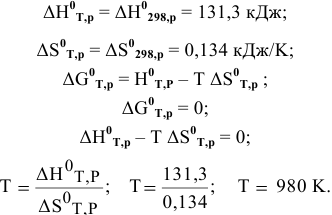
Задача № 6. Расчеты по химическому сродству.
Пример 57
Можно ли использовать магний для получения титана по следующей реакции:
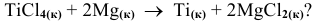
Известны изобарно-изотермические потенциалы соединения:
Решение:
Можно подтвердить возможность реакции расчетом ее энергии Гиббса, однако более удобно использовать понятие химического сродства.
Энергия Гиббса бинарного соединения, отнесенная к единице химической связи, характеризует химическое сродство друг к другу двух химических элементов, образующих химическую связь.
Чем более отрицательна величина энергии Гиббса, отнесенная к единице химической связи одного элемента с рядом других элементов, тем выше его химическое сродство к этим элементам:
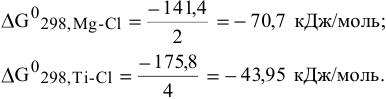
Можно заключить, что химическое сродство хлора к магнию более высокое, чем к титану. Таким образом, реакция 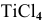 с магнием термодинамически возможна в стандартных условиях.
с магнием термодинамически возможна в стандартных условиях.
Пример 58
Какой оксид среди перечисленных термически более стабилен?
Известно следующее:
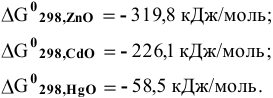
Решение:
Термическая стабильность определяется отношением к реакции разложения:
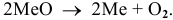
Оксид является термически более стойким, если он менее склонен к реакции разложения.
Величины энергии Гиббса оксидов характеризуют именно данную реакцию (обратная реакция является реакцией образования оксида из простых веществ).
Таким образом, чем более отрицательны величины AG оксидов, тем они термически более стойки. Иначе, используем понятие химического сродства: чем более отрицательно значение энергии Гиббса оксида, отнесенной к единице связи «металл-кислород», тем больше химическое сродство металла к кислороду, а значит, оксид термически более стойкий.
В изученных оксидах число связей Ме=О одинаково, значит сравниваем величины энергий Гиббса самих оксидов.
Сравнение дает следующий результат:
- термически более стойкий оксид цинка;
- термически менее стойкий оксид ртути.
Известно, что при нагревании оксид ртути разлагается:
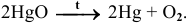
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

