Оглавление:
Расчеты по уравнениям химических реакций
Задача:
Пусть общая схема химической реакции —
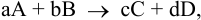
где А и В — исходные вещества;
С и D — продукты реакции;
a, b, c, d — коэффициенты.
Тогда можно записать уравнение
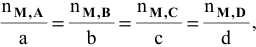
где 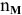 — число молей каждого вещества, участвующего в реакции.
— число молей каждого вещества, участвующего в реакции.
Предположим, что количество данных веществ выражено следующим образом:
а) для А — в молях;
б) для В-в объеме (то есть В — газообразное вещество);
в) для С — в граммах;
г) для D — количеством молекул.
Так как известно, что
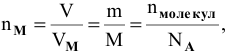
получаем формулу для расчетов по уравнению химической реакции:
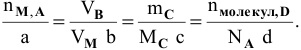
Задача:
Определить число молей углекислого газа  , полученного в результате сгорания 24 г углерода.
, полученного в результате сгорания 24 г углерода.
Решение:
Уравнение реакции горения углерода —
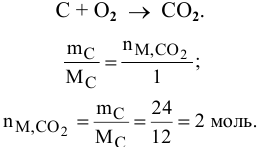
Задача:
Определить объем кислорода, необходимый для сгорания 17 г аммиака.
Решение:
Уравнение реакции горения аммиака —
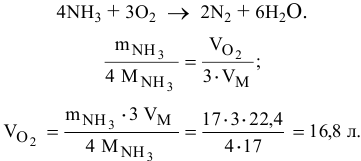
Задача:
Определить число молекул воды, образующееся при сгорании 10 л метана, н.у.
Решение:
Уравнение реакции горения метана —
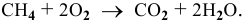
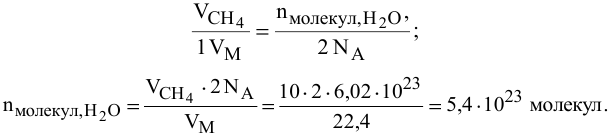
Задача:
Какую массу оксида кальция и какой объем углекислого газа (н.у.) можно получить при термическом разложении 20 г известняка, содержащего 80 % карбоната кальция?
Решение:
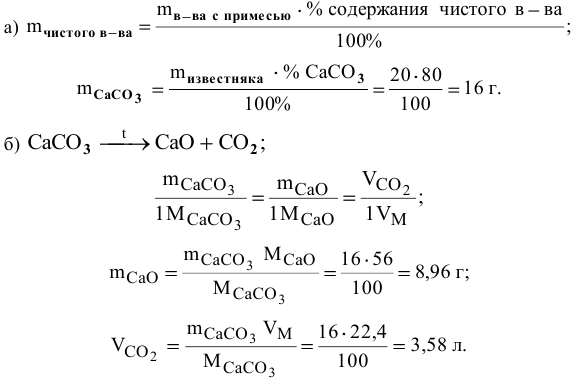
Задача:
Расчеты по уравнению химической реакции с избытком одного из реактивов.
Предположим, что реактив В взят в избытке, тогда формула для расчетов по уравнению химических реакций примет вид
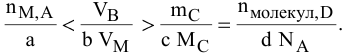
Член уравнения, содержащий реактив в избытке, исключается из расчетов. Расчеты ведут по реактиву, взятому в недостатке. Возможен также расчет избытка реактива:
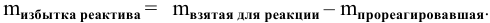
Задача:
Определить массу нитрата натрия, образующегося в результате взаимодействия 130 г азотной кислоты с двумя моль гидроксида натрия. Какой реактив взят в избытке и какова масса избытка этого реактива?
Решение:
Определяем вещество в избытке:
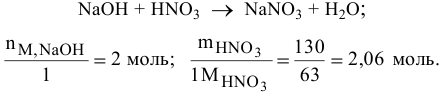
Таким образом, азотная кислота взята в избытке:
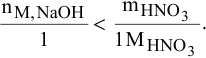
Расчет производится по реактиву, взятому в недостатке, т.е. по гидроокиси натрия:
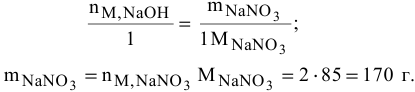
Расчет массы кислоты, необходимой для реакции с двумя моль гидроокиси натрия:
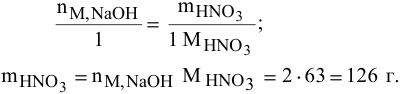
Расчет массы избытка азотной кислоты:
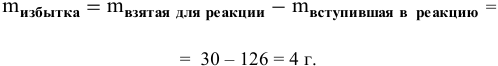
Задача:
Расчеты с практическим выходом реакции.
Практический выход реакции 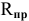 — это отношение реального количества полученного вещества к его теоретически возможному количеству согласно уравнению реакции:
— это отношение реального количества полученного вещества к его теоретически возможному количеству согласно уравнению реакции:

Задача:
Получено 620 г кислорода электролизом 40 моль воды. Определить практический выход реакции.
Решение:
а) Вначале рассчитываем теоретическую массу кислорода по уравнению реакции
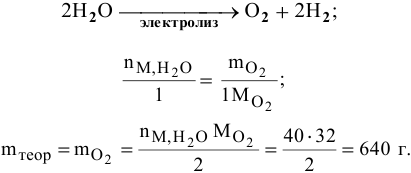
б) Определяем практический выход реакции
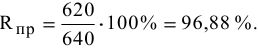
Задача:
Практический выход реакции синтеза аммиака равен 30%. Какова масса аммиака, полученного из 90 л водорода, взятого для реакции синтеза (н.у.)?
Решение:
а) Находим теоретическую массу аммиака:
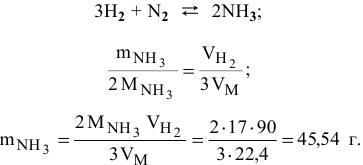
б) Находим по практическому выходу реакции реальную массу аммиака:
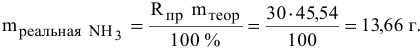
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

