Оглавление:
Расчеты по газовым законам (нормальныеусловия)
Для осуществления любого расчета по газовым законам для нормальных условий используются следующие формулы:
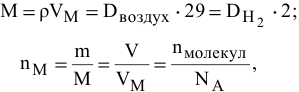
где М — молярная масса, г/моль;
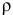 — плотность газа, г/л;
— плотность газа, г/л;
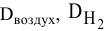 . ~ относительные плотности по воздуху и по водороду;
. ~ относительные плотности по воздуху и по водороду;
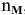 — число молей газа;
— число молей газа;
m — масса газа, г;
V — объем газа, л;
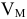 — молярный объем,
— молярный объем, 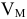 = 22,414 л/моль;
= 22,414 л/моль;
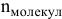 — число молекул газа;
— число молекул газа;
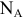 — число Авогадро,
— число Авогадро, 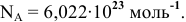
Используя эти две формулы, можно рассчитать, например:
- число молекул, содержащихся в определенном объеме газа;
- число молей, содержащихся в определенном объеме газа;
- объем, занимаемый определенной массой газа;
- массу определенного объема газа;
- плотность и относительную плотность газа по молярной массе газа;
- молярную массу неизвестного газа на основе плотности или относительной плотности.
Пример 16
Найти число молекул 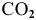 , содержащихся в 11,2 л углекислого газа (н.у.).
, содержащихся в 11,2 л углекислого газа (н.у.).
Решение:
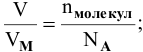
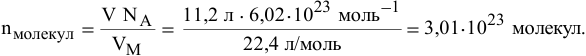
Пример 17
Определить число молей 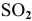 , содержащихся в 3 л сернистого газа (и.у.).
, содержащихся в 3 л сернистого газа (и.у.).
Решение: 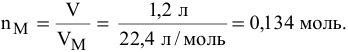
Пример 18
Найти объем, занимаемый 32 г 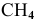 (н.у.).
(н.у.).
Решение: 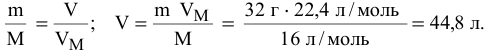
Пример 19
Определить массу одного литра кислорода (н.у.).
Решение: 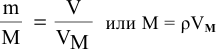 , так как масса одного литра, по определению, — это плотность,
, так как масса одного литра, по определению, — это плотность, 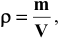
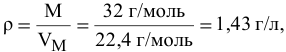
т.е. масса одного литра газа m = 1,43 г.
Пример 20
Найти относительную плотность хлора по воздуху.
Решение: 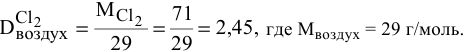
Пример 21
Найти молярную массу неизвестного газа, если относительная плотность его по водороду равна 22.
Решение: 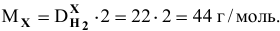
Пример 22
Определить объем, занимаемый 2 моль углекислого газа (н.у.).
Решение: 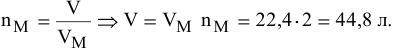
Пример 23
Определить объем, занимаемый 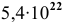 молекулами кислорода (н.у.).
молекулами кислорода (н.у.).
Решение:
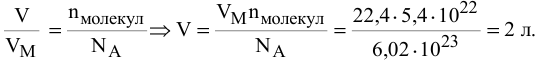
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

