Оглавление:
Пример 1
Найти эмпирическую формулу оксида железа, зная, что кислород двухвалентен, а железо трехвалентно.
Решение:
Записываем символы химических элементов и обозначаем римскими цифрами валентности элементов:
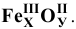
Для определения индексов воспользуемся правилом взаимной насыщаемости валентностей:
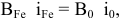
где В — валентность; i — индекс.
Находим самое простое отношение между индексами железа и кислорода:
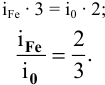
Эмпирическая формула искомого оксида железа 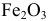 .
.
Пример 2
Найти валентность азота в оксиде азота 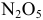 . Известно, что валентность кислорода постоянна и равна 2.
. Известно, что валентность кислорода постоянна и равна 2.
Решение:
Применим правило взаимной насыщаемости валентностей:
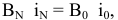
откуда 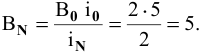
Валентность азота в 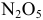 равна 5.
равна 5.
Пример 3
Определение относительной молекулярной массы в химических соединениях.
Пусть 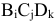 — химическое соединение, где В, С, D — химические элементы; i, j, k — их индексы.
— химическое соединение, где В, С, D — химические элементы; i, j, k — их индексы.
Тогда 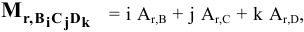 где
где 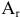 — относительная атомная масса.
— относительная атомная масса.
Пример 3
Определить относительную молекулярную массу сульфата натрия 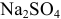 .
.
Решение:
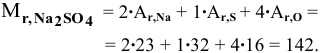
Пример 4
Определение молярной массы химических соединений по эмпирической формуле.
Для соединения 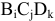 мы имеем:
мы имеем:
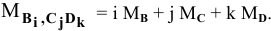
Пример 5
Определить молярную массу нитрата кальция 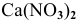 .
.
Решение:
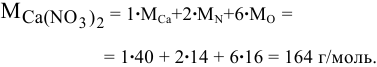
Пример 6
Определение числа молей 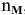 , содержащихся в определенной массе простых и сложных веществ:
, содержащихся в определенной массе простых и сложных веществ:
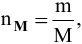
где 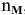 — число молей;
— число молей;
m — масса вещества, г;
М — молярная масса, г/моль.
Пример 7
Определить число молей атомов в 60 г углерода.
Решение:
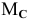 = 12 г/моль;
= 12 г/моль;
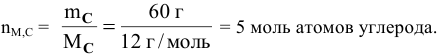
Пример 8
Определить число молей молекул в 300 г углекислого кальция 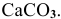 .
.
Решение:
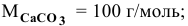
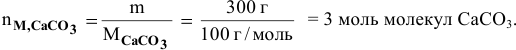
Пример 9
Определение числа атомов и молекул, содержащихся в определенной массе вещества:
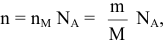
где n — число атомов в простом веществе или число молекул в сложном веществе;
 — число Авогадро,
— число Авогадро, 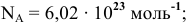
m — масса вещества, г;
М — его молярная масса, г/моль.
Пример 10
Найти число атомов в 3,2 г серы.
Решение: 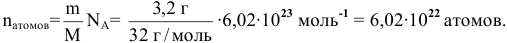
Пример 11
Найти число молекул 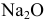 в 6,2 г оксида натрия.
в 6,2 г оксида натрия.
Решение:
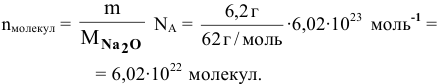
Пример 12
Определение абсолютной массы атомов и молекул:
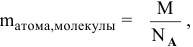
где 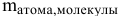 выражена в граммах.
выражена в граммах.
Пример 13
Определить массу молекулы NO.
Решение:
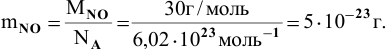
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

