Оглавление:
Окислительно-восстановительные процессы. Коррозия
Задача 143
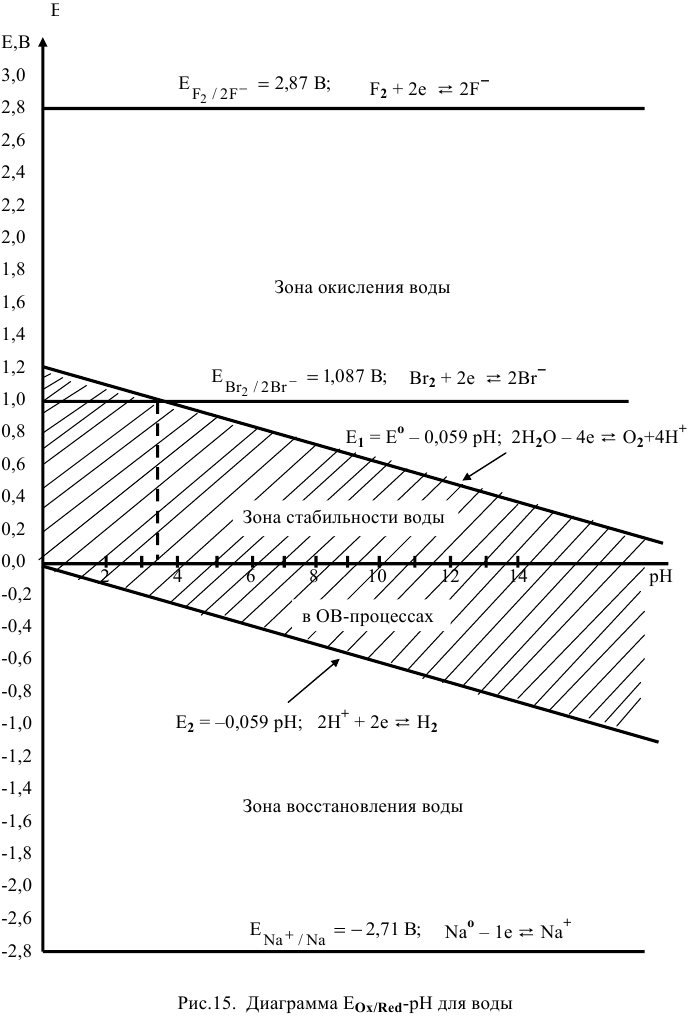
Построить диаграмму 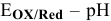 воды. При каких значениях pH будут окислять воду фтор и хлор? При каких значениях pH будет восстанавливать воду Na?
воды. При каких значениях pH будут окислять воду фтор и хлор? При каких значениях pH будет восстанавливать воду Na?
Решение:
Для воды характерны два процесса:
1. Окисление: 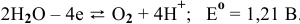 .
.
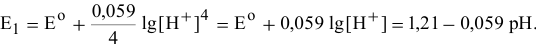
Для различных значений 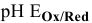 принимают следующие значения:
принимают следующие значения:

2. Восстановление: 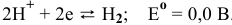 .
.
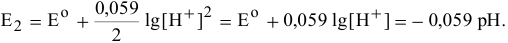
Для различных значений 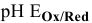 принимают следующие значения:
принимают следующие значения:

Диаграмма 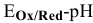 воды показана на рис. (рис. 15).
воды показана на рис. (рис. 15).
Редокс-потенциалы фтора, брома и натрия не зависят от pH, поэтому на диаграмме 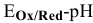 представлены горизонтальными линиями.
представлены горизонтальными линиями.
При всех значениях pH редокс-потенциал фтора выше редокс-потенциала воды при ее окислении, поэтому фтор окисляет воду при любых значениях pH.
Для брома редокс-потенциал выше редокс-потенциала воды при рН>3,5, поэтому бром может окислять воду только при рН>3,5.
Натрий имеет редокс-потенциал намного ниже, чем редокс-потенциал воды при ее восстановлении, поэтому натрий восстанавливает воду при любых значениях pH.
Задача 144
Цинк опущен в раствор с концентрацией ионов 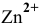 , равной
, равной 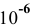 моль/л. Построить диаграмму
моль/л. Построить диаграмму 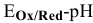 . Указать, при каких значениях pH цинк наиболее подвержен коррозии.
. Указать, при каких значениях pH цинк наиболее подвержен коррозии.
Решение:
В задаче № 4 подразд.22.2 определены интервалы pH различных форм соединений цинка.
При pH < 8,5 в растворе находятся ионы 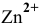 , а при
, а при 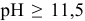 — ионы
— ионы 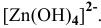
При pH < 8,5 существует следующее равновесие:
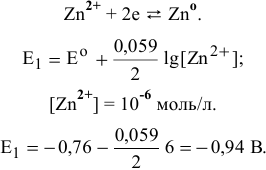
При 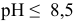 редокс-потенциал цинка не зависит от pH.
редокс-потенциал цинка не зависит от pH.
При 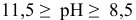 существует следующее равновесие:
существует следующее равновесие:
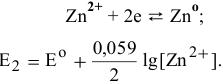
Концентрация ионов 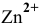 находится из выражения произведения растворимости:
находится из выражения произведения растворимости:

Определяем значения редокс-потенциала для различных значений pH:
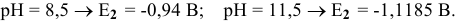
При 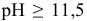 концентрация ионов
концентрация ионов 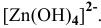 не меняется и остается равной 10’6 моль/л, при этом существует следующее равновесие:
не меняется и остается равной 10’6 моль/л, при этом существует следующее равновесие:
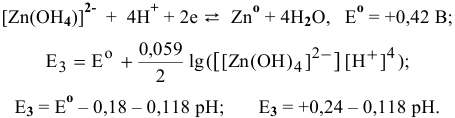
Определяем значения редокс-потенциала для различных значений pH:
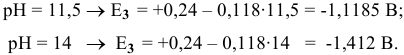
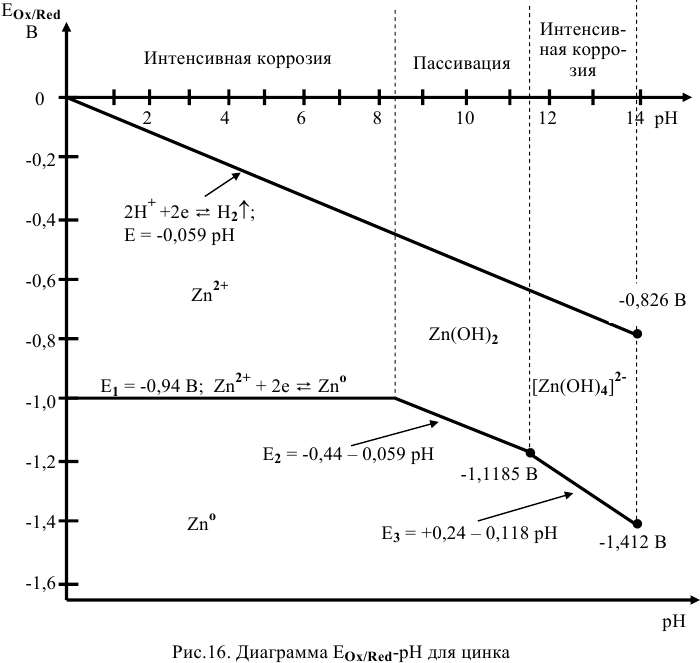
Построим диаграмму 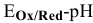 для цинка (рис. 16). Из построенной диаграммы
для цинка (рис. 16). Из построенной диаграммы 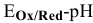 для цинка, а также процесса восстановления воды видно, что если поместить
для цинка, а также процесса восстановления воды видно, что если поместить 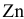 в водный раствор при любом значении
в водный раствор при любом значении 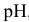 , металл подвержен окислению.
, металл подвержен окислению.
При 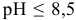 цинк переходит в раствор в виде катионов
цинк переходит в раствор в виде катионов 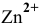 , при
, при 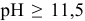 цинк переходит в раствор в виде анионов
цинк переходит в раствор в виде анионов 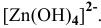 , во всех случаях протекает интенсивная коррозия цинка. При
, во всех случаях протекает интенсивная коррозия цинка. При 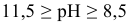 скорость коррозии малая за счет образования пассивирующей (нерастворимой) пленки
скорость коррозии малая за счет образования пассивирующей (нерастворимой) пленки 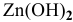 .
.
Задача 145
Для следующих полуреакций:
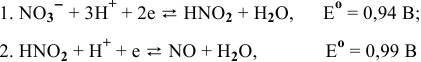
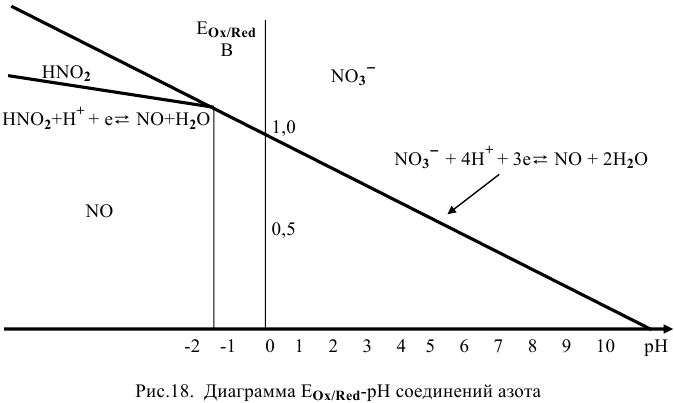
построить диаграмму 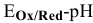 . Показать, что в кислой среде азотистая кислота диспропорционирует. Показать, что выше определенного значения
. Показать, что в кислой среде азотистая кислота диспропорционирует. Показать, что выше определенного значения 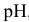 (какого?) при обычной температуре реакция диспропорционирования практически не имеет места.
(какого?) при обычной температуре реакция диспропорционирования практически не имеет места.
Решение:
Для обеих полуреакций на диаграмме (рис. 17) проводим прямые 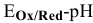 , уравнения которых следующие:
, уравнения которых следующие:
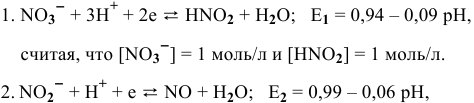
считая, что 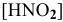 = 1 моль/л.
= 1 моль/л.
Выше прямой 1 имеется окисленная форма 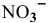 первой системы, ниже прямой 1 — ее восстановленная форма
первой системы, ниже прямой 1 — ее восстановленная форма 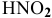 .
.

Выше прямой 2 имеется окисленная форма 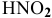 второй системы, а ниже прямой 2 — ее восстановленная форма NO.
второй системы, а ниже прямой 2 — ее восстановленная форма NO.
На диаграмме (рис. 18) видно, что единственной областью существования 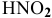 является область между прямыми 1 и 2 при pH < -1,66. Следует отметить, что значения pH ниже -1,66 не существуют.
является область между прямыми 1 и 2 при pH < -1,66. Следует отметить, что значения pH ниже -1,66 не существуют.
При pH > -1,66 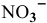 восстанавливается непосредственно в NO, поэтому этот процесс выражается третьей полуреакцией:
восстанавливается непосредственно в NO, поэтому этот процесс выражается третьей полуреакцией:
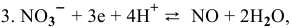
в которой зависимость 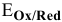 от pH выражается уравнением:
от pH выражается уравнением:
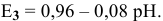
Задача 146
Согласно нижеприведенной (рис. 19) диаграмме 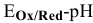 для хлора в воде (при обычных температурах, концентрациях всех участвующих веществ, равных 1 моль/л, и давлении газа, равном
для хлора в воде (при обычных температурах, концентрациях всех участвующих веществ, равных 1 моль/л, и давлении газа, равном 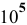 Па) найти уравнения каждой прямой и соответствующие каждой прямой полуреакции. Объяснить, почему прямые лимитированы определенными сегментами.
Па) найти уравнения каждой прямой и соответствующие каждой прямой полуреакции. Объяснить, почему прямые лимитированы определенными сегментами.
Решение:
Рассмотрим последовательно следующие полуреакции:
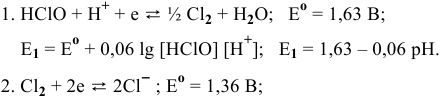
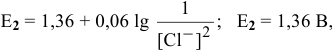
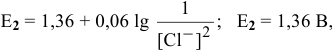 не зависит от pH.
не зависит от pH.
Прямые 1 и 2 (рис. 19) пересекутся при 1,63 — 0,06 pH = 1,36, откуда pH =4,5.
При pH > 4,5 равновесие 1 не существует, так как хлор не может существовать в растворе, он подвергается диспропорционированию:
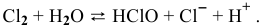
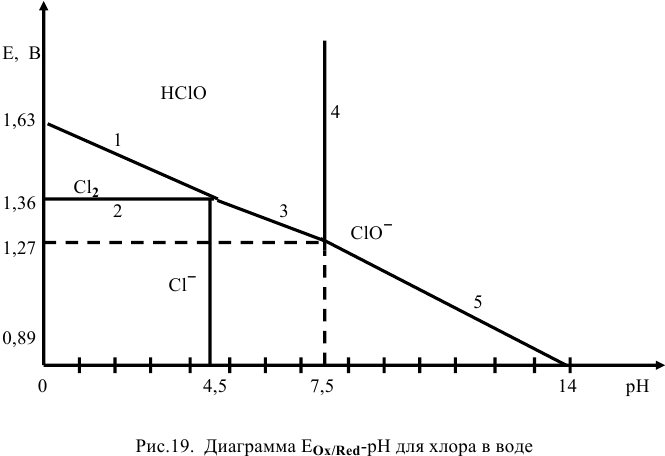
Третье равновесие дает прямой переход от 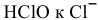 :
:
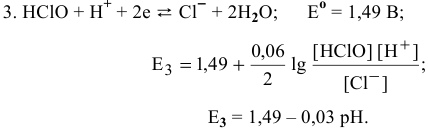
Прямая, выражающая третье равновесие, лимитирована отрезком, так как 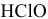 существует лишь до pH = 7,5 (при pH = 7,5 концентрации
существует лишь до pH = 7,5 (при pH = 7,5 концентрации 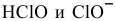 становятся равными).
становятся равными).
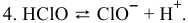
Это равновесие диссоциации кислоты не зависит от редокс-потенциала, поэтому оно представлено отрезком прямой, параллельным оси ординат: pH = 7,5.
Пересечение прямых 4 и 3 дает точку, потенциал которой
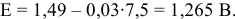
При pH > 7,5 существует равновесие 5:
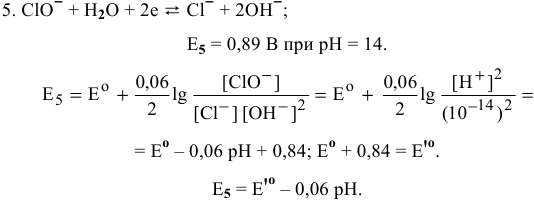
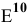 определяем, зная, что
определяем, зная, что 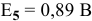 при pH = 14:
при pH = 14:
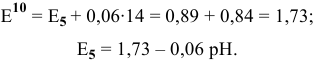
Все эти прямые, выражающие соответствующие равновесия, лимитированы отрезками, так как при определенных значениях pH один из составных компонентов равновесия не может существовать.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Задачи повышенной трудности. Электролитическая диссоциация. Буферные растворы. Гидролиз |
| Задачи с решениями на произведение растворимости |
| Задачи с решениями по оксидам |
| Задачи с решениями по основаниям |

