Оглавление:
Окислительно-восстановительные (ов) реакции
Задача 66
Определить степень окисления азота в следующих молекулах и ионах: 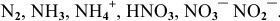
Решение:
При определении степени окисления элемента пользуемся правилом: сумма степеней окисления всех элементов равна заряду частицы (для молекулы 0, а для иона — заряд иона).
Известно, что степень окисления водорода равна +1, а степень окисления кислорода равна -2 (кроме перекисных соединений).
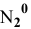 — степень окисления азота, равна 0.
— степень окисления азота, равна 0.
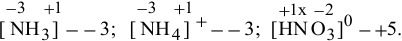
Для 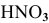 составим уравнение:
составим уравнение:
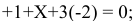
X = +5 (степень окисления N в 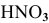 );
);
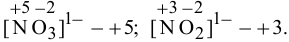
Задача 67
Определить степень окисления всех элементов, входящих в состав следующих молекул: 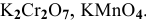 .
.
Решение:
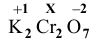
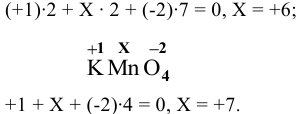
Задача № 3. Найти среди указанных веществ такие, которые могут выполнять роль: только окислителя; только восстановителя; окислителя и восстановителя.
Пример
Сгруппировать вещества по способности их выполнять определенную роль в ОВ реакциях: 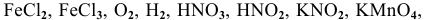
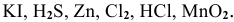
Решение:
Пользуемся следующим правилом: молекулы, атомы которых могут лишь повышать свои степени окисления, играют роль только восстановителей; молекулы, атомы которых могут лишь понижать свои степени окисления, играют роль только окислителей; молекулы, атомы которых могут повышать и понижать свои степени окисления, могут играть роль как окислителей, так и восстановителей.
Только окислители — 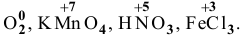
Только восстановители — 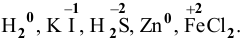
Окислители и восстановители — 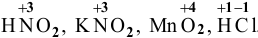
По каждому веществу необходимо дать подробное объяснение. Например, 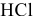 — и окислитель, и восстановитель, потому что
— и окислитель, и восстановитель, потому что 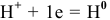 — процесс восстановления (окислитель);
— процесс восстановления (окислитель); 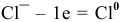 — процесс окисления (восстановитель). Таким образом,
— процесс окисления (восстановитель). Таким образом, 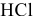 — окислитель за счет
— окислитель за счет 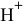 и восстановитель за счет
и восстановитель за счет 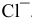 .
.
Задача № 4. Уравнять ОВ реакции методом электронного баланса.
Пример 89
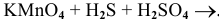
Решение:
1. Среди участвующих в реакции веществ находим окислитель и восстановитель.
В 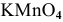 марганец проявляет свою максимальную степень окисления (+7), значит, он может быть только окислителем.
марганец проявляет свою максимальную степень окисления (+7), значит, он может быть только окислителем.
В 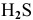 сера проявляет свою минимальную степень окисления (-2), значит, она может быть только восстановителем.
сера проявляет свою минимальную степень окисления (-2), значит, она может быть только восстановителем.
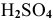 в этой реакции служит для создания кислой среды:
в этой реакции служит для создания кислой среды:
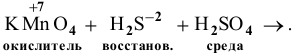
2. В случае отсутствия продуктов реакции определяем их, основываясь на знании степеней окисления элементов и химических свойств участвующих в реакции веществ.
В кислой среде 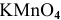 восстанавливается до
восстанавливается до 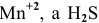 окисляется до
окисляется до 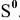 . Кроме того, образуются
. Кроме того, образуются 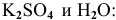
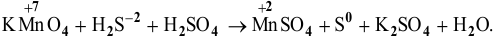
3. Составляем электронный баланс согласно закону сохранения заряда (число электронов, принятых окислителем, должно равняться числу электронов, отданных восстановителем):
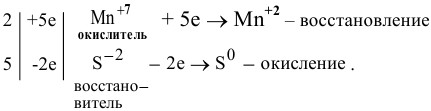
4. Расставляем соответствующие коэффициенты перед окислителем и восстановителем до и после реакции:
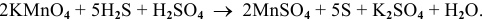
5. Уравниваем число атомов металлов, не участвующих в окислении-восстановлении. В данной реакции — это атомы К, число которых уже уравнено.
6. Уравниваем кислотные остатки, не участвующие в окислении-восстановлении. В данной реакции — это 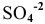 :
:
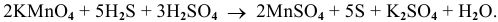
7. Уравниваем число атомов водорода:
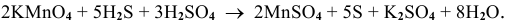
8. Проверяем число атомов кислорода.
Если число атомов кислорода не уравнено, ошибку в уравнении следует
начинать искать с первого этапа.
Пример 90
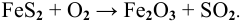
Решение: 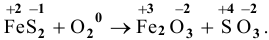
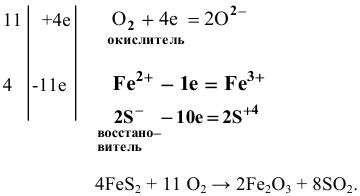
Пример 91
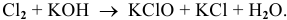 .
.
Решение: С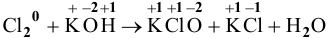
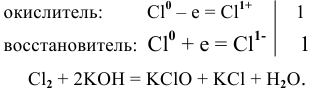
Это реакция диспропорционирования.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Задачи с решениями на электролитическую диссоциацию |
| Задачи с решениями на водородный показатель |
| Задачи с решениями на электрохимические расчеты |
| Задачи с решениями на электролиз растворов |

