Оглавление:
Обзор свойств р-элементов
Задача 89
Почему фтор не проявляет положительную степень окисления? Почему его валентность равна 1, тогда как он находится в седьмой группе периодической системы Д.И.Менделеева ?
Решение. Смотреть тему «Химическая связь».
Задача 90
Объяснить, почему 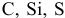 проявляют четные характерные валентности, тогда как
проявляют четные характерные валентности, тогда как 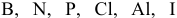
проявляют нечетные характерные валентности.
Решение. Смотреть ту же тему.
Задача 91
Хорошо известно, что окислительные свойства неметаллов в группах увеличиваются снизу вверх, однако фосфор проявляет более высокую окислительную активность, нежели азот, несмотря на то, что он находится ниже азота. Объяснить это явление.
Решение:
Азот существует в виде молекул 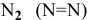 , обладающих тройной связью, энергия которой равна 225 ккал/моль. Энергия связи р-р в молекуле
, обладающих тройной связью, энергия которой равна 225 ккал/моль. Энергия связи р-р в молекуле 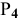 фосфора равна 48 ккал/моль. Таким образом, энергия активации достаточно высокая для азота, с чем связана его сравнительно низкая окислительная активность. В данном случае в проявлении активности вещества преобладающим является кинетический фактор химического процесса.
фосфора равна 48 ккал/моль. Таким образом, энергия активации достаточно высокая для азота, с чем связана его сравнительно низкая окислительная активность. В данном случае в проявлении активности вещества преобладающим является кинетический фактор химического процесса.
Задача 92
Почему фосфор встречается в природе только лишь в связанном состоянии, тогда как азот может существовать и в свободном состоянии?
Решение:
Такое явление объясняется химической активностью простых веществ. Азот по сравнению с фосфором проявляет очень слабую активность, поэтому он встречается в природе в свободном состоянии (газ 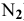 ).
).
Задача 93
Можно ли использовать бор или углерод для восстановления 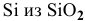 ?
?
Решение:
Для ответа на этот вопрос необходимо знать химическое сродство всех этих элементов к кислороду. Значения 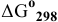 образования соединений:
образования соединений:
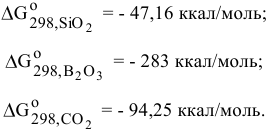
Определяем 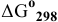 реакции восстановления:
реакции восстановления:
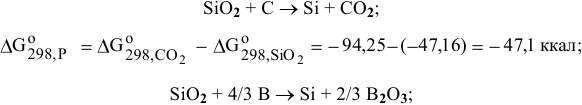
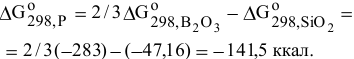
Стандартные энергии Гиббса обеих реакций имеют отрицательные значения, таким образом, можно сделать заключение о том, что химическое сродство В и С по отношению к кислороду выше, чем химическое сродство Si по отношению к кислороду. Это означает, что для восстановления 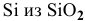 могут быть использованы В и С.
могут быть использованы В и С.
Задача 94
Указать метод получения брома исходя из следующих реактивов: 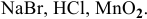
Решение:
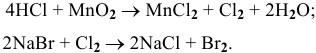
Задача 95
Используя величины энергий Гиббса, сравнить химическую активность галогенов по отношению к металлам.
Решение:
Изучим химическую активность галогенов 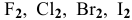 по отношению к металлам на примере Са:
по отношению к металлам на примере Са:
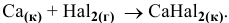
Находим в справочнике значения 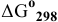 галидов Са, образующихся в результате реакции:
галидов Са, образующихся в результате реакции:
Согласно значениям энергии Гиббса химическое сродство галогенов по отношению к кальцию увеличивается в ряду 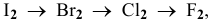 таким образом, в этом же ряду химическая активность галогенов по отношению к металлам увеличивается.
таким образом, в этом же ряду химическая активность галогенов по отношению к металлам увеличивается.
Задача 96
Привести примеры реакций, в которых хлор: а) проявляет окислительные свойства; б) проявляет восстановительные свойства; в) подвергается окислительно-восстановительному диспропорционированию.
Решение:
а) Для того, чтобы хлор проявлял окислительные свойства, он должен понижать свою степень окисления:
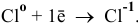
Например:
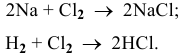
б) Восстановительные свойства хлор будет проявлять тогда, когда он будет повышать свою степень окисления, например до 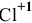 :
:
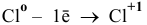
или же
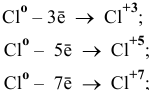
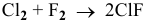
в) Диспропорционирование предполагает одновременное повышение и понижение степени окисления, например:
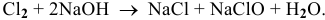
Задача 97
Составить и уравнять с помощью электронного баланса следующие ОВ-реакции.
Решение:
Ниже приводятся уже составленные и уравненные реакции:
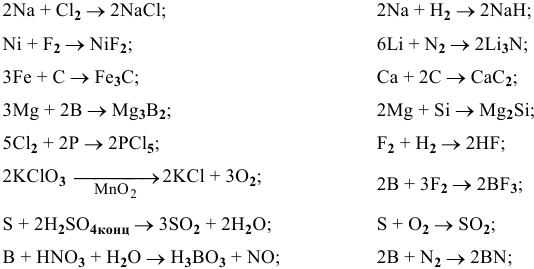
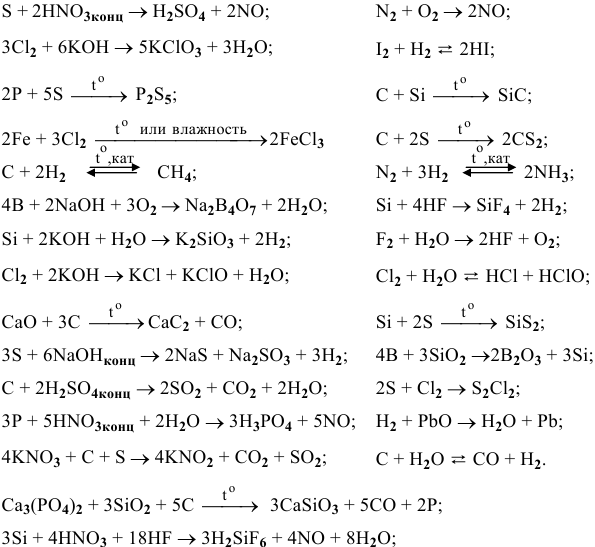
Задача 98
Определить теоретический выход реакции синтеза аммиака при стандартной температуре (азот и водород взяты в стехиометрическом соотношении, концентрация азота в исходной смеси равна 0,1 моль/л). Что необходимо сделать для повышения теоретического выхода аммиака?
Решение: 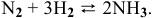
Рассчитываем 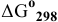 реакции:
реакции:
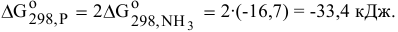
Рассчитываем константу равновесия:
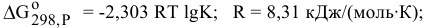
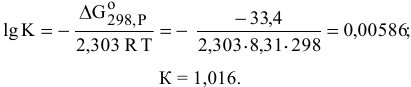
По величине константы равновесия определяем концентрации в состоянии равновесия:
в исходном состоянии — 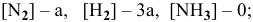
в состоянии равновесия — 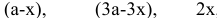 ,
,
где х — количество 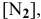 подвергающееся преобразованию, т.е. вступившее в реакцию.
подвергающееся преобразованию, т.е. вступившее в реакцию.
Математическое выражение константы равновесия —
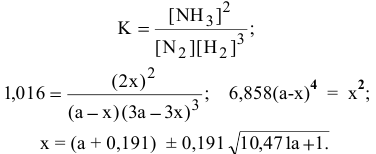
При а = 0,1 моль/л х = 0,0178.
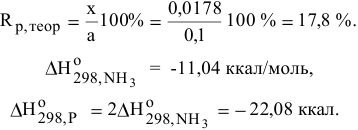
Реакция синтеза аммиака экзотермическая. Для увеличения теоретического выхода реакции синтеза аммиака необходимо понижение температуры и увеличение давления.
Задача 99
Используя значения окислительно-востановительных потенциалов, определить возможность протекания следующих окислительно-восстановительных реакций:
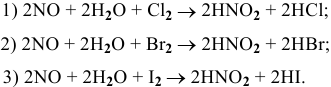
Решение:
В общем виде все три реакции записываются уравнением
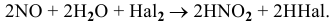
Данная ОВ реакция состоит из двух следующих полуреакций:
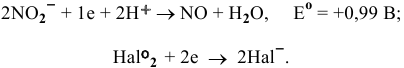
В данных реакциях галоген должен играть роль окислителя. ЭДС этих реакций определяется по формуле
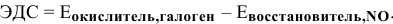
Чтобы ЭДС была положительной, должно выполняться следующее условие:
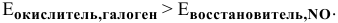
Находим в справочнике [4] значения стандартных ОВ потенциалов галогенов:
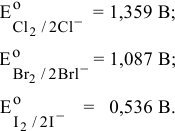
Значение ОВ потенциалов хлора и брома выше, чем у восстановителя NO, значит, первые две реакции возможны, а так как ЭДС для второй реакции имеет небольшую величину (< 0,3 В), то вторая реакция обратима. Реакция с иодом в прямом направлении невозможна.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

