Оглавление:
Обзор химических свойств d-металлов
Пример 113
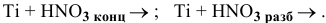
Решение:
Так как большинство d-металлов склонно к образованию защитных оксидных пленок, то под действием концентрированной азотной кислоты, являющейся активным окислителем, поверхность титана (как и 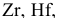
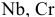 ) покрывается плотным оксидным слоем:
) покрывается плотным оксидным слоем:
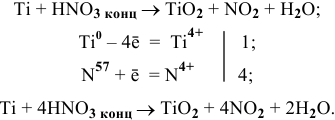
Происходит пассивация металла, реакция прекращается.
Разбавленная азотная кислота при нагревании довольно активно разрушает металл:
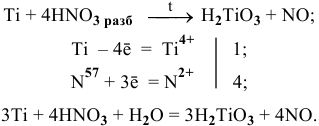
Пример 114
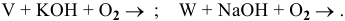
Решение:
Co щелочами реагируют металлы, оксиды и гидроксиды которых амфотерны. Данные металлы могут реагировать с расплавами щелочей в присутствии окислителя:
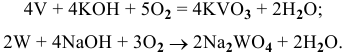
Задача № 2. По степени окисления определить характер оксидов и гидроксидов d-металлов. Показать с помощью уравнений реакций химические свойства данных соединений.
Пример 115
Определить характер оксидов: 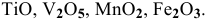
Решение:
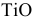 является основным оксидом. В нем титан проявляет минимальную степень окисления. Для основных оксидов характерны реакции с кислотами:
является основным оксидом. В нем титан проявляет минимальную степень окисления. Для основных оксидов характерны реакции с кислотами:
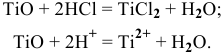
Оксид 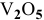 кислотный, так как ванадий в нем проявляет максимальную степень окисления.
кислотный, так как ванадий в нем проявляет максимальную степень окисления. 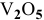 можно растворить в щелочи:
можно растворить в щелочи:
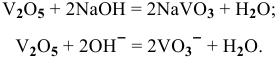
Оксиды 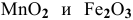 — амфотерные соединения с промежуточной степенью окисления элементов. Они взаимодействуют как с кислотами, так и со щелочами. Рассмотрим на примере диоксида марганца:
— амфотерные соединения с промежуточной степенью окисления элементов. Они взаимодействуют как с кислотами, так и со щелочами. Рассмотрим на примере диоксида марганца:
Пример 116
Составить формулы гидроксидов d-металлов: 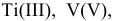 ,
, 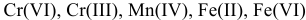 — и дать им названия.
— и дать им названия.
Решение:
Гидроксиды — это и основания, и кислоты, т.е. продукты прямого или косвенного взаимодействия оксидов с водой. Их характер зависит, прежде всего, от проявляемой элементом степени окисления. Поэтому, если образуемый d-металлом оксид основной, ему соответствует основание, если кислотный — кислота, для амфотерного оксида присущи две формы существования гидроксидов.
В данных примерах 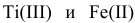 образуют основания
образуют основания 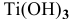 и
и 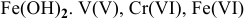 соответствуют кислоты:
соответствуют кислоты:
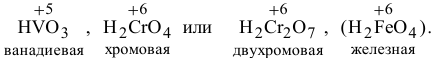
Последняя кислота гипотетическая, обнаружены только ее соли -ферраты. Для оксидов  характерна амфотерность. Поэтому гидроксиды их пишем в двух формах:
характерна амфотерность. Поэтому гидроксиды их пишем в двух формах:
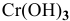 — гидроксид
— гидроксид  — гидроксид
— гидроксид 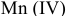 и
и 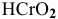 — хромистая кислота;
— хромистая кислота; 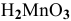 — марганцеватистая кислота.
— марганцеватистая кислота.
В названиях кислот, где элемент проявляет минимальную степень окисления, появляется суффикс “ист”.
Пример 117
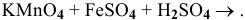
Решение:
Определяем степень окисления элементов, входящих в состав реагирующих веществ: 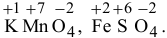 . Серная кислота выполняет роль среды. В кислой среде перманганат калия, в котором марганец проявляет максимальную степень окисления, выступает в роли окислителя, восстанавливаясь до
. Серная кислота выполняет роль среды. В кислой среде перманганат калия, в котором марганец проявляет максимальную степень окисления, выступает в роли окислителя, восстанавливаясь до 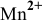 . А ионы железа
. А ионы железа 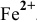 , в которых проявляется одна из минимальных степеней окисления элемента, выступают в роли восстановителя, окисляясь до более устойчивого состояния —
, в которых проявляется одна из минимальных степеней окисления элемента, выступают в роли восстановителя, окисляясь до более устойчивого состояния — 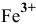 . Составляем схему всей реакции, используя в качестве противоионов ионы
. Составляем схему всей реакции, используя в качестве противоионов ионы 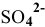 :
:
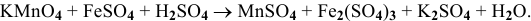
Уравниваем одним из методов, например электронно-ионным:
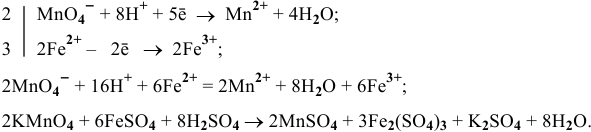
Пример 118
Вычислить процентное содержание титана в рутиле 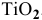 .
.
Решение:
Определим молярную массу 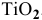 :
:
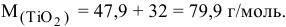
На долю титана в нем приходится 47,9 г, что составляет:
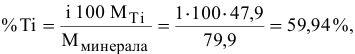
где i — число атомов металла в молекуле.
Пример 119
Какую массу железа можно получить из 1 т руды, содержащей 20 % пустой породы и минерал магнетит 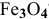 ?
?
Решение:
1) От одной тонны руды 20 % пустой породы составляют 200 кг. Следовательно, на долю магнетита приходится 800 кг.
2) Используя молярную массу 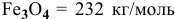 и зная, что на долю железа в ней приходится 168 кг, определим массу железа в 1 т руды:
и зная, что на долю железа в ней приходится 168 кг, определим массу железа в 1 т руды:
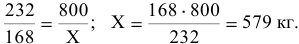
Задача № 5. Вывести формулу минерала.
Пример 120
Вывести простейшую формулу минерала, имеющего следующий состав: 36,8 % железа, 31,6 % титана, 31,6 % кислорода.
Решение:
Обозначим формулу соединения через  .
.
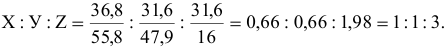
Простейшая формула минерала 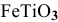 — это ильменит.
— это ильменит.
Пример 121
Восстановлением 1,8186 г одного из оксидов ванадия металлическим кальцием и последующим растворением образовавшегося СаО в соляной кислоте получили 1,0188 г чистого ванадия. Вывести простейшую формулу оксида.
Решение:
Обозначим формулу оксида через 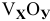 . Найдем массу кислорода в навеске оксида:
. Найдем массу кислорода в навеске оксида:
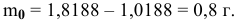
Зная молярные массы кислорода (16 г/моль) и ванадия (50,94 г/моль),
найдем количество атомов каждого элемента в молекуле:
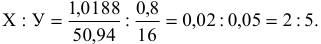
Следовательно, простейшая формула оксида — 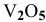 .
.
Пример 122
Определить объем воздуха (содержит 21 объемный процент кислорода) в нормальных условиях, необходимый для окислительного обжига 1250 кг 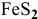 , содержащего 20 % примесей.
, содержащего 20 % примесей.
Решение:
Определяем массу чистого 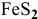 :
:
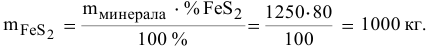
Рассчитываем число молей 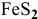 , содержащихся в 1000 кг
, содержащихся в 1000 кг 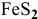 :
:
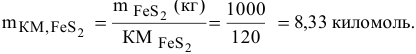
Уравнение реакции окислительного обжига 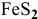 —
—
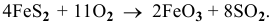
Определяем объем кислорода, необходимый для реакции:
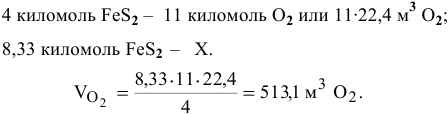
Определяем объем воздуха:
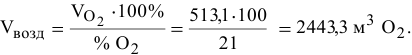
Пример 123
Вычислить массу ванадия, которая получится из 23,4 г метаванадата аммония, и массу алюминия, необходимую для восстановления ванадия из 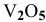 .
.
Решение:
Запишем химические процессы, протекающие при производстве ванадия:
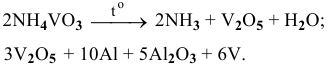
Вначале по уравнению реакции (1) рассчитаем количество 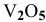 , образующегося из 23,4 г
, образующегося из 23,4 г 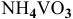 , если
, если 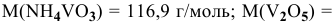 181,8 г/моль:
181,8 г/моль:
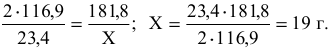
Затем определим количество ванадия, которое может быть получено из 19 г его оксида:
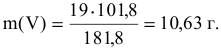
По уравнению (2) рассчитаем массу алюминия, необходимого для получения 10,63 г ванадия:
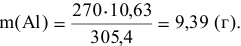
Пример 124
Рассчитать энергию Гиббса и возможность восстановления оксида никеля NiO водородом двумя способами: а) используя стандартные значения  соединений; б) используя стандартные значения
соединений; б) используя стандартные значения 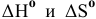 в уравнении Гиббса.
в уравнении Гиббса.
Решение:
а) Из таблицы находим значения 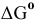 для NiO и
для NiO и 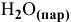 .
.
Из следствия закона Гесса имеем:
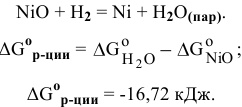
Так как 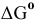 < 0, процесс восстановления NiO водородом возможен.
< 0, процесс восстановления NiO водородом возможен.
б) Из таблицы находим значения 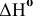 для
для 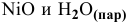 , а также
, а также 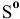 для всех компонентов системы и рассчитаем изменение энтропии реакции и тепловой эффект реакции:
для всех компонентов системы и рассчитаем изменение энтропии реакции и тепловой эффект реакции:
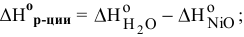
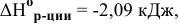
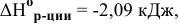 , т.е. реакция экзотермическая;
, т.е. реакция экзотермическая;
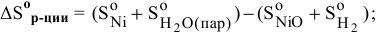
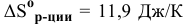 , т.е. реакция сопровождается возрастанием энтропии.
, т.е. реакция сопровождается возрастанием энтропии.
По уравнению Гиббса 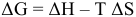 определим знак
определим знак 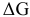 :
:
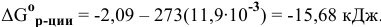
Вывод тот же, что и в первом случае, — процесс восстановления никеля водородом возможен в стандартных условиях.
Пример 125
При растворении 36 г сплава цинка с медью в азотной кислоте выделилось 6,58 л газообразных продуктов при 24 °C и 792 мм рт.ст. Вычислить процентный состав сплава, если это взаимодействие выражается уравнением:
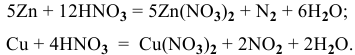
Решение:
Обозначим массу цинка, содержащегося в сплаве, через X г, а массу меди — (36-Х) г. Выразим объем азота при н.у. в соответствии с уравнением (1):

Выразим объем двуокиси азота при н.у. в соответствии с уравнением (2):

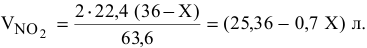
Приводим к н.у. объем газовой смеси:
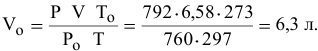
Приравниваем сумму объемов 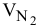 и
и 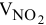 к объему
к объему 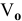 полученной смеси газов:
полученной смеси газов:
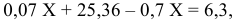
отсюда
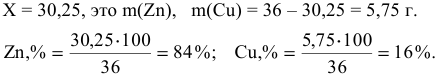
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

