Оглавление:
Коррозия металлов. Методы защиты металлов от коррозии
Задача 74
Железная пластинка погружается в разбавленный раствор 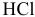 . Наблюдается выделение водорода с ее поверхности. Если дотронуться до этой пластинки медной проволокой, водород начинает выделяться с поверхности медной проволоки, хотя железо продолжает растворяться, причем более интенсивно. Объяснить это явление. Написать катодный и анодный процессы электрохимической коррозии. Указать продукт коррозии.
. Наблюдается выделение водорода с ее поверхности. Если дотронуться до этой пластинки медной проволокой, водород начинает выделяться с поверхности медной проволоки, хотя железо продолжает растворяться, причем более интенсивно. Объяснить это явление. Написать катодный и анодный процессы электрохимической коррозии. Указать продукт коррозии.
Решение:
При погружении железной пластинки в раствор 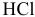 происходит гетерогенная ОВ реакция:
происходит гетерогенная ОВ реакция:
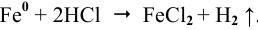
При касании железа медью образуется короткозамкнутый гальванический элемент, состоящий из железного и медного электродов, загруженных в раствор электролита. Медный электрод играет роль катода, так как он имеет более высокий электродный потенциал. На катоде должен протекать процесс восстановления, а на аноде — железной пластине — процесс окисления:
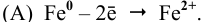
Таким образом, железо продолжает растворяться, причем скорость электрохимического процесса выше, чем скорость обычного окислительно-восстановительного процесса.
На катоде происходит деполяризация, т.е. процесс восстановления каких-либо частиц, называемых деполяризатором, избытком электронов.
В кислой среде роль деполяризатора играют катионы водорода:
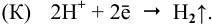
Таким образом, водород выделяется с поверхности меди, несмотря на отсутствие взаимодействия  с ней. Продукт коррозии —
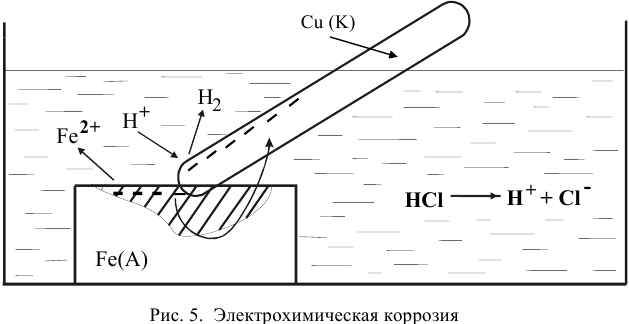
с ней. Продукт коррозии —  . Процессы, происходящие при электрохимической коррозии, представлены на рис. 5.
. Процессы, происходящие при электрохимической коррозии, представлены на рис. 5.
Задача 75
Две пластинки — одна железная, а другая магниевая -погружены раздельно в разбавленную соляную кислоту. Что изменится, если соединить обе пластинки?
Решение:
Обе пластинки, находящиеся раздельно в разбавленной 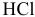 , будут реагировать с ней с выделением водорода, так как
, будут реагировать с ней с выделением водорода, так как 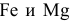 находятся в ряду напряжений до водорода:
находятся в ряду напряжений до водорода:
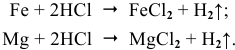
При объединении пластин образуется короткозамкнутый гальванический элемент, и протекает электрохимическая коррозия. Магний, будучи более активным металлом, играет роль анода. На аноде происходит процесс окисления:
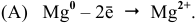
На катоде — железной пластинке — будет происходить водородная деполяризация:
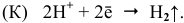
Таким образом, при соприкосновении двух пластин наблюдается усиление выделения водорода с поверхности железа, хотя разрушение железа резко уменьшается, а активизируется процесс разрушения магниевой пластины. Выделение водорода с поверхности магния резко сокращается.
Задача 76
Кладут в один стакан, содержащий солевой раствор, кусочек чистого железа, а в другой стакан, содержащий такой же солевой раствор, — кусочек железа, соединенный с кусочком свинца. В оба стакана есть доступ кислороду воздуха. Через несколько дней определяют содержание ионов железа в обоих стаканах. В каком из стаканов концентрация ионов железа будет больше ?
Решение:
Кислород растворяется в водном растворе. Железо, погруженное в солевой раствор, в присутствии растворенного кислорода будет подвергаться коррозии, хотя и медленно, так как оно чистое, а чистые металлы медленно корродируют (обычно присутствие примесей в железе (чугуне) резко увеличивает скорость коррозии).
Процесс коррозии чистого железа может быть представлен следующей схемой:
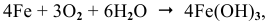
где 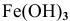 , — один из компонентов ржавчины.
, — один из компонентов ржавчины.
Железо в контакте с менее активным свинцом играет роль анода и подвергается электрохимической коррозии с кислородной деполяризацией на свинцовом катоде:
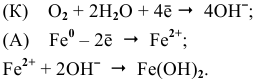
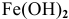 легко окисляется до
легко окисляется до 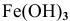 . Таким образом, продуктом коррозии является
. Таким образом, продуктом коррозии является 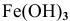 :
:
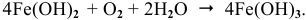
Скорость электрохимической коррозии намного выше скорости химической коррозии, поэтому в стакане, содержащем железо, соединенное со свинцом, концентрация ионов железа 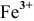 будет выше, чем в стакане с чистым железом.
будет выше, чем в стакане с чистым железом.
Задача 77
Описать процессы электрохимической коррозии, протекающие на оцинкованном железе при наличии трещин в защитном слое:
а) в кислой среде;
б) в нейтральной среде в присутствии кислорода.
Решение:
Покрытие железа цинком относится к анодным покрытиям, так как металл покрытия более активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль анода.
В кислой среде на поверхности катода, т.е. на поверхности железа, протекает водородная деполяризация (рис.6):
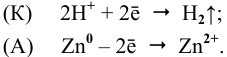
В нейтральной среде в присутствии кислорода на поверхности катода (железа) протекает кислородная деполяризация (рис.7):
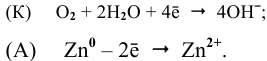
Продукт коррозии, образующийся по реакции
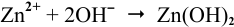 — гидроксид цинка.
— гидроксид цинка.
Задача 78
Описать процессы электрохимической коррозии,
протекающей на хромированном железе при наличии трещин в защитном слое:
а) в кислой среде;
б) в нейтральной среде в присутствии кислорода.
Решение:
Покрытие железа хромом относится к катодным покрытиям, так как металл покрытия менее активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль катода.
Защищаемый металл играет роль анода, т.е. подвергается разрушению.
В кислой среде на поверхности катода, т.е. на поверхности хрома, протекает водородная деполяризация (рис.8):
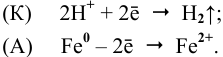
В нейтральной среде в присутствии кислорода на поверхности катода (хрома) протекает кислородная деполяризация (рис.9):
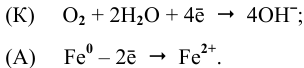
Продукт коррозии, образующийся по реакции
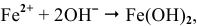
на воздухе окисляется:
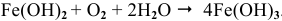
Задача 79
Объяснить, почему в стальном сосуде застойная зона подвергается интенсивной коррозии (нейтральная среда в присутствии кислорода воздуха), тогда как в цинковом сосуде, наоборот, застойная зона подвергается коррозии в незначительной степени.
Решение:
Интенсивность (скорость) электрохимической коррозии зависит от ЭДС образующегося короткозамкнутого элемента: чем больше величина ЭДС, тем интенсивнее электрохимическая коррозия.
Для электрохимической коррозии ЭДС рассчитывается аналогично расчету ЭДС гальванического элемента:
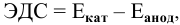
где 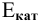 — электродный потенциал электродной полуреакции деполяризации;
— электродный потенциал электродной полуреакции деполяризации;
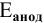 — электродный потенциал металла, подвергающегося разрушению.
— электродный потенциал металла, подвергающегося разрушению.
Для электродной полуреакции кислородной деполяризации
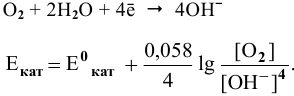
В зоне, подверженной воздействию кислорода, электродный потенциал катодных участков будет выше, чем в застойной зоне (концентрация кислорода в растворе находится в числителе). Таким образом, в начальный момент ЭДС микрогальваноэлементов в зоне, подверженной воздействию кислорода, будет выше, чем ЭДС микрогальваноэлементов в застойной зоне, а значит, коррозия анодных участков в зонах, подверженных воздействию кислорода, будет значительной. Эта коррозия в начальный момент приводит к накоплению анионов 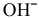 по реакции
по реакции 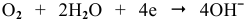 , а следовательно, к увеличению pH. Известно, что в щелочной среде железо пассивирует. Таким образом, в следующий момент коррозия в зонах, подверженных воздействию кислорода, прекращается, тогда как в застойных зонах
, а следовательно, к увеличению pH. Известно, что в щелочной среде железо пассивирует. Таким образом, в следующий момент коррозия в зонах, подверженных воздействию кислорода, прекращается, тогда как в застойных зонах 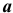 (рис. 10) она продолжается. Вот почему застойные зоны стальных сосудов подвергаются интенсивной коррозии.
(рис. 10) она продолжается. Вот почему застойные зоны стальных сосудов подвергаются интенсивной коррозии.
В сосуде из цинка коррозия зон, подверженных воздействию кислорода, всегда будет очень интенсивной, так как щелочная среда не пассивирует цинк, а наоборот, способствует его разрушению:
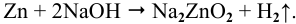
Поэтому застойная зона меньше подвергается коррозии, чем аэрируемая.
Задача 80
Показать необходимыми расчетами, что платина в контакте с золотом никогда не подвергается электрохимической коррозии, тогда как медь в контакте в золотом подвергается электрохимической коррозии только в присутствии кислорода в щелочной среде.
Решение:
Для процесса кислородной деполяризации
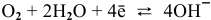
электродный потенциал определяется по формуле Нернста:

В нейтральной среде 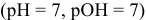
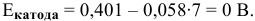
В щелочной среде 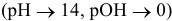
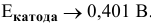
Для того, чтобы протекала электрохимическая коррозия, необходимо следующее:
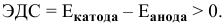
Отсюда
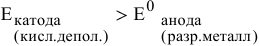
Таким образом, электродный потенциал металла (анода) должен быть ниже 0 В в нейтральной среде или ниже 0,401 В в сильно щелочной среде (рН=14). Если находятся в контакте золото и платина, платина играет роль анода, но ее стандартный электродный потенциал 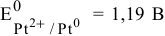 . Хотя в реальных условиях из-за низкой концентрации катионов платины электродный потенциал платины будет ниже, чем ее стандартный потенциал, однако он остается выше, чем 0,401 В, а значит, электрохимической коррозии с кислородной деполяризацией не будет.
. Хотя в реальных условиях из-за низкой концентрации катионов платины электродный потенциал платины будет ниже, чем ее стандартный потенциал, однако он остается выше, чем 0,401 В, а значит, электрохимической коррозии с кислородной деполяризацией не будет.
Медь в контакте с золотом может подвергаться электрохимической коррозии с кислородной деполяризацией, особенно в щелочной среде, так как 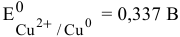 , а это ниже 0,401 В.
, а это ниже 0,401 В.
Остается показать отсутствие электрохимической коррозии с водородной деполяризацией для обоих случаев.
Электродный потенциал водородной деполяризации выражается уравнением:
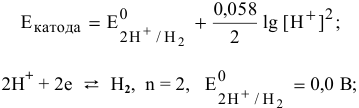
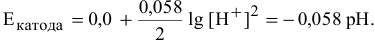
В кислой среде 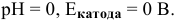
В слабокислой среде 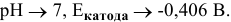
Таким образом, металлы, имеющие электродный потенциал выше 0 В, в кислой среде не подвергаются электрохимической коррозии с водородной деполяризацией.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Задачи с решениями на электрохимические расчеты |
| Задачи с решениями на электролиз растворов |
| Задачи с решениями на химические свойства металлов |
| Задачи с решениями на обзор химических свойств d-металлов |

