Оглавление:
Комплексные соединения
Задача 107
Назвать следующие комплексные соединения. Определить координационное число, заряд комплексообразователя и заряд внутренней сферы: 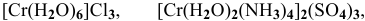 ,
,
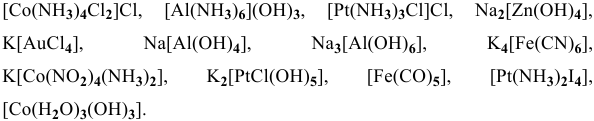
Решение:
а) Катионные комплексы:
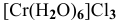 — гексааквахром(Ш) хлорид,
— гексааквахром(Ш) хлорид,
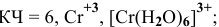
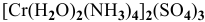 — тетраамминдиаквахром(Ш) сульфат,
— тетраамминдиаквахром(Ш) сульфат,
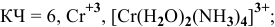
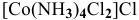 — дихлоротетраамминкобальт(Ш) хлорид,
— дихлоротетраамминкобальт(Ш) хлорид,
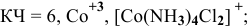
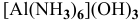 — гексаамминалюминий(Ш) гидроксид,
— гексаамминалюминий(Ш) гидроксид,
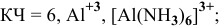
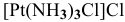 — монохлоротриамминплатина(П) хлорид,
— монохлоротриамминплатина(П) хлорид,
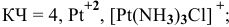
б) Анионные комплексы:
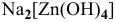 — тетрагидроксоцинкат(П) натрия,
— тетрагидроксоцинкат(П) натрия,
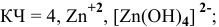
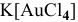 — тетрахлороаурат (III) калия,
— тетрахлороаурат (III) калия,
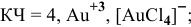
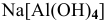 — тетрагидроксоалюминат(Ш) натрия,
— тетрагидроксоалюминат(Ш) натрия,
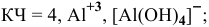
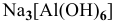 — гексагидроксоалюминат(Ш) натрия,
— гексагидроксоалюминат(Ш) натрия,
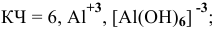
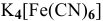 — гексацианоферрат(П) калия,
— гексацианоферрат(П) калия,
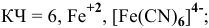
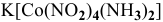 — тетранитродиамминкобальтат(Ш) калия,
— тетранитродиамминкобальтат(Ш) калия,
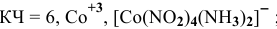
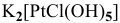 — монохлоропентагидроксоплатинат(1У) калия,
— монохлоропентагидроксоплатинат(1У) калия,
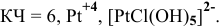
в) Нейтральные комплексы: 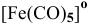 — пентакарбонил железа, КЧ = 5,
— пентакарбонил железа, КЧ = 5, 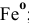 ;
;
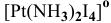 — тетраиододиаммин платина(1У) КЧ = 6,
— тетраиододиаммин платина(1У) КЧ = 6, 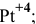
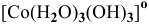 — тригидроксотриаквакобальт(Ш), КЧ = 4,
— тригидроксотриаквакобальт(Ш), КЧ = 4, 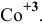
Задача 108
Написать формулы следующих комплексных соединений по их названиям. Определить координационное число и заряд внутренней сферы.
Решение:
Далее приводятся одновременно названия комплексных соединений и их формулы:
1) трихлоромононитродиамминплатина — 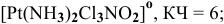 ;
;
2) динитромонохлоротриамминкобальт — 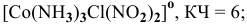
3) монобромотриамминплатина(П) бромид — 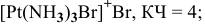
4) монохлоромононитротетраамминплатина(1У) хлорид — 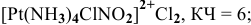
5) гексаамминжелеза(Ш) иодид — 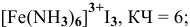 ;
;
6) тетранитродиамминкобальтат(Ш) калия — 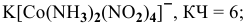
7) монобромопентанитроплатинат (1V) калия — 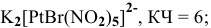
8) гексахлороплатинат (1V) натрия — 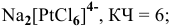
9) гексацианоферрат(Ш) калия — 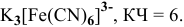
Задача 109
Применив метод валентных схем, найти координационное число 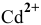 в комплексных соединениях. Привести примеры комплексных ионов, в которых реализуется данное координационное число.
в комплексных соединениях. Привести примеры комплексных ионов, в которых реализуется данное координационное число.
Решение:
Электронная конфигурация атома 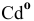 следующая:
следующая:
Для катиона
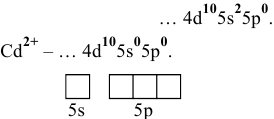
Обладая 4 свободными квантовыми ячейками, катион 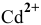 может играть роль акцептора электронных дублетов, проявляя при этом координационное число 4.
может играть роль акцептора электронных дублетов, проявляя при этом координационное число 4.
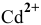 будет реагировать предпочтительно с анионами или с полярными молекулами, обладающими свободными электронными парами.
будет реагировать предпочтительно с анионами или с полярными молекулами, обладающими свободными электронными парами.
Например:
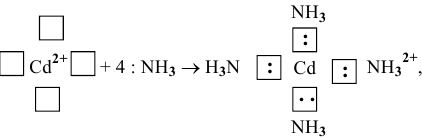
т.е. 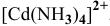
Аналогично:
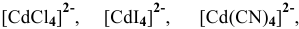
Задача 110
Обладая какой степенью окисления, водород может входить в состав комплексных ионов ?
Решение:
В состоянии окисления +1 водород может играть роль акцептора электронной пары, значит, он может образовывать комплекс, играя роль лиганда, с комплексообразователем, играющим роль донора, т.е. имеющим свободную электронную пару, например:
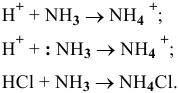
В состоянии окисления -1 водород должен играть роль донора, например:
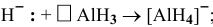
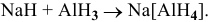
Задача 111
Почему растворимость иода выше в растворе KI, чем в воде?
Решение:
Более высокая растворимость иода в водном растворе KI по сравнению с растворимостью в воде объясняется образованием комплекса 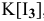 , обладающего более высокой растворимостью, чем иод
, обладающего более высокой растворимостью, чем иод 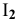 :
:
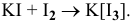
Задача 112
Исходя из каких веществ и каким способом можно получить следующие комплексные соединения:  ,
,
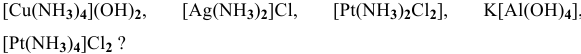
Решение:
1) 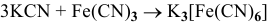 — реакция соединения;
— реакция соединения;
2) 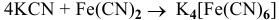 — реакция соединения;
— реакция соединения;
3) 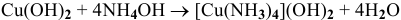 — реакция внедрения;
— реакция внедрения;
4) 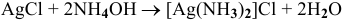 — реакция внедрения;
— реакция внедрения;
5) 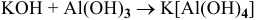 — реакция соединения;
— реакция соединения;
6) 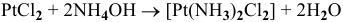 — реакция внедрения;
— реакция внедрения;
7) 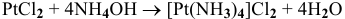 — реакция соединения.
— реакция соединения.
Задача 113
Составить и уравнять следующие схемы реакции.
Решение:
Далее приводятся уже составленные и уравненные химические реакции:
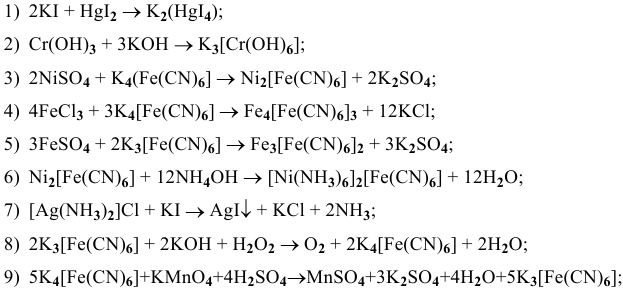
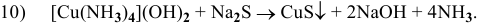
Задача 114
Написать уравнения электролитической диссоциации следующих комплексных соединений: 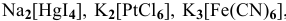
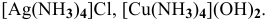 .
.
Пример решения: Комплексная соль 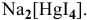 .
.
Комплексное соединение диссоциирует на ион внутренней сферы и ионы внешней сферы как сильный электролит:
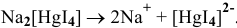
Комплексный ион диссоциирует как слабый электролит — диссоциация ступенчатая:
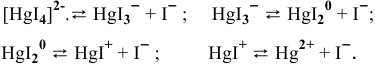
Суммарное уравнение диссоциации комплексного иона следующее:
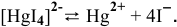
Задача 115
Написать математическое выражение констант нестойкости следующих комплексных ионов: 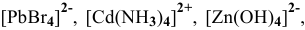
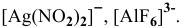 .
.
Пример решения: Для комплексного иона 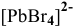 :
:
I ступень 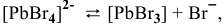
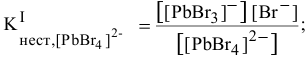
II ступень 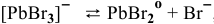 ,
,
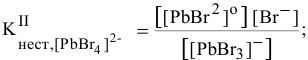
III ступень 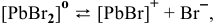 ,
,
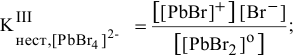
IV ступень 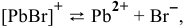
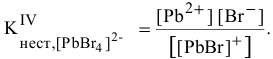
Суммарное уравнение диссоциации комплексного иона:
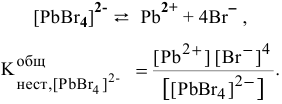
Задача 116
Рассчитать концентрацию ионов 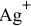 в растворе, 1 л которого содержит 0,01 моль
в растворе, 1 л которого содержит 0,01 моль 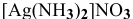 и 1 моль
и 1 моль 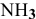 .
.
Решение:
Константа нестойкости комплексного иона 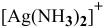
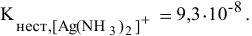
Суммарное уравнение его диссоциации:
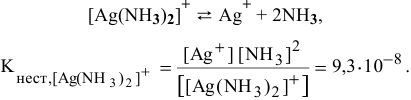
Концентрация ионов, создаваемая диссоциацией комплексного иона, ничтожна по сравнению с созданной концентрацией 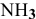 в растворе, поэтому мы ею пренебрегаем:
в растворе, поэтому мы ею пренебрегаем:
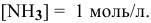
Предположив, что диссоциация комплексной соли на комплексный ион и ионы внешней сферы протекает полностью, находим концентрацию иона по формуле
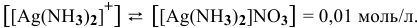
Находим концентрацию ионов серебра:
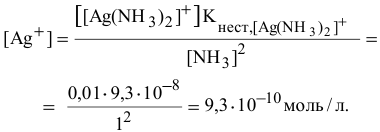
Задача 117
Рассчитать концентрацию ионов 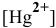 в 0,1 М растворе
в 0,1 М растворе 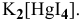 .
.
Решение:
Суммарное уравнение диссоциации 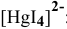 :
:
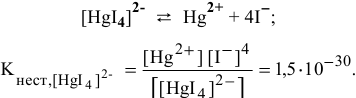
Предположив, что диссоциация комплексной соли на комплексный ион и ионы внешней сферы протекает полностью, находим концентрацию комплексного иона по формуле
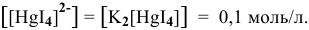
Концентрацию ионов 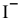 находим из выражения константы нестойкости I ступени, так как константа нестойкости I ступени самая высокая, а значит, и концентрация ионов
находим из выражения константы нестойкости I ступени, так как константа нестойкости I ступени самая высокая, а значит, и концентрация ионов 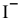 , полученных по I ступени, будет самой высокой. Концентрация же ионов
, полученных по I ступени, будет самой высокой. Концентрация же ионов  , образованных по следующим трем этапам, будет намного меньше, чем концентрация ионов
, образованных по следующим трем этапам, будет намного меньше, чем концентрация ионов 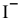 , полученных по I ступени, а значит, можно пренебречь остальными тремя этапами для приблизительных расчетов.
, полученных по I ступени, а значит, можно пренебречь остальными тремя этапами для приблизительных расчетов.
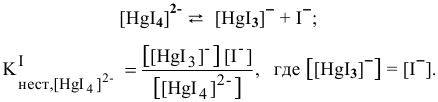
Отсюда
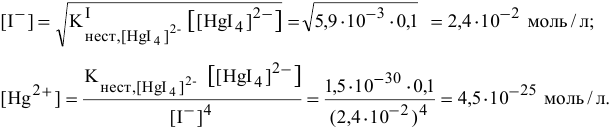
Задача 118
Можно ли получить осадок 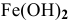 действием
действием 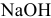 с концентрацией ионов
с концентрацией ионов 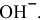 , равной 1 моль/л, на 1 М растворы
, равной 1 моль/л, на 1 М растворы 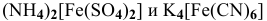 ?
?
Решение:
Осаждение малорастворимого соединения начинается тогда, когда достигается величина произведения растворимости. Необходимое условие осаждения 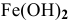 следующее:
следующее:
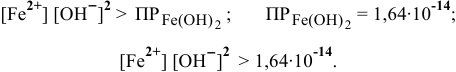
Так как [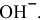 ] = 1 моль/л, [
] = 1 моль/л, [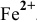 ] > 1,64-
] > 1,64-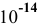 моль/л.
моль/л.
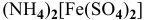 — двойная соль, ее внутренняя сфера диссоциирует на ионы полностью. Предположив, что
— двойная соль, ее внутренняя сфера диссоциирует на ионы полностью. Предположив, что 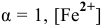 считаем равной 1 моль/л. Таким образом, концентрация ионов
считаем равной 1 моль/л. Таким образом, концентрация ионов 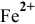 в соли
в соли 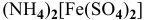 выше 1,64-
выше 1,64-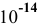 , а значит, осаждение
, а значит, осаждение 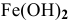 будет наблюдаться:
будет наблюдаться:
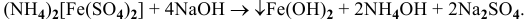
Для комплексной соли 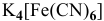 концентрация ионов
концентрация ионов 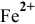 будет очень малой. Расчет ее по методике предыдущей задачи дает следующие результаты:
будет очень малой. Расчет ее по методике предыдущей задачи дает следующие результаты: 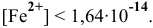
Таким образом, осаждение 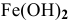 наблюдаться не будет:
наблюдаться не будет:
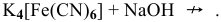
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

