Оглавление:
Химическая связь
Пример 42
Укажите все возможные валентности для С1.
Решение:
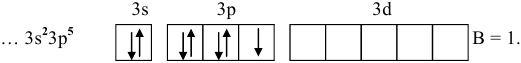
Строение внешнего электронного слоя хлора следующее:
Нормальное состояние:
Возбужденные состояния:
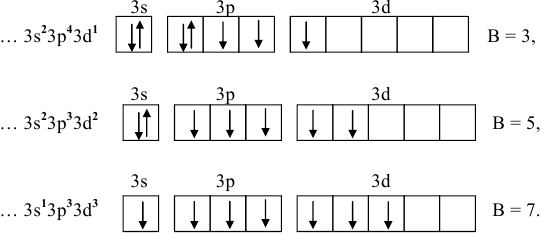
Для хлора, как и для любого другого химического элемента, находящегося в нечетной группе, число электронов нечетное, а последовательное их возбуждение дает всегда нечетное число неспаренных электронов. Таким образом, их валентности будут нечетными.
Задача № 2. Объяснить, почему молекула 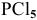 существует, тогда как молекула
существует, тогда как молекула 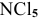 не существует, а также объяснить причину следующего: молекула
не существует, а также объяснить причину следующего: молекула 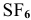 существует, а молекула
существует, а молекула 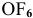 не существует; молекула
не существует; молекула 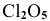 существует, а молекула
существует, а молекула 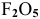 не существует.
не существует.
Пример 43
Объяснить, почему молекула 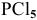 существует, а молекула
существует, а молекула 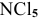 не существует.
не существует.
Решение:
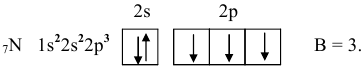
Молекула 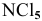 не может существовать, так как азот имеет только 3 неспаренных электрона, дающих 3 химические связи. Распаривание двух s-электронов в пределах второго последнего энергетического уровня невозможно. Электронное строение атома азота:
не может существовать, так как азот имеет только 3 неспаренных электрона, дающих 3 химические связи. Распаривание двух s-электронов в пределах второго последнего энергетического уровня невозможно. Электронное строение атома азота:
Возможно существование молекулы 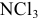 .
.
На последнем электронном уровне у азота может находиться два электронных подуровня. Таким образом, нет возможности возбуждения атома азота в пределах существующих энергетических уровней.
Для фосфора картина иная, его последний электронный уровень (n=3) имеет три электронных подуровня. В невозбужденном состоянии фосфор проявляет валентность 3, а в возбужденном — 5. Таким образом, фосфор может образовать соединение 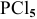 . Электронное строение атома фосфора:
. Электронное строение атома фосфора:
невозбужденное состояние 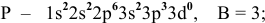
возбужденное состояние 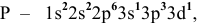
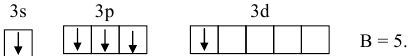
Задача № 3. Представить схемы образования химических связей в молекулах:  — по методу валентных связей (МВС) и по методу молекулярных орбиталей (ММО).
— по методу валентных связей (МВС) и по методу молекулярных орбиталей (ММО).
Пример 44
Представить схему образования химической связи в  по МВС и по ММО.
по МВС и по ММО.
Решение:
Согласно методу валентных связей схема молекулы  следующая:
следующая:

Согласно методу молекулярных орбиталей схема образования молекулы 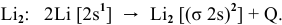
Энергетическая схема образования молекулы 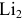 по ММО:
по ММО:
Задача № 4. Рассмотрите перекрывание: 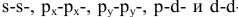 — орбиталей. В каких случаях образуются
— орбиталей. В каких случаях образуются 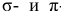 -связи?
-связи?
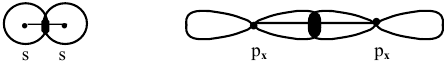
Решение:
При перекрывании 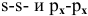 -орбиталей образуется
-орбиталей образуется 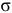 -связь.
-связь.
Схема образования 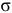 -связи:
-связи:
При перекрывании 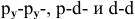 -орбиталей образуется
-орбиталей образуется  -связь.
-связь.
Схема образования 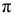 -связи:
-связи:
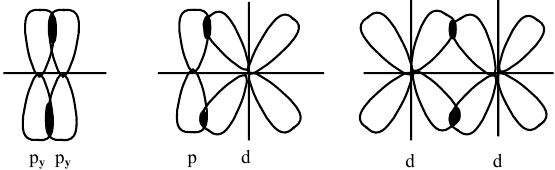
Задача № 5. Укажите типы химических связей в молекулах следующих соединений: 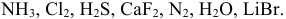
Решение:
Определим разность электроотрицательностей взаимодействующих атомов в соединениях:
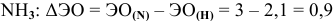 — связь ковалентная полярная.
— связь ковалентная полярная.
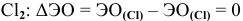 — связь ковалентная неполярная.
— связь ковалентная неполярная.
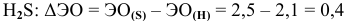 — связь ковалентная полярная.
— связь ковалентная полярная.
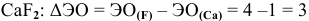 — связь ионная.
— связь ионная.
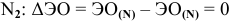 — связь ковалентная неполярная.
— связь ковалентная неполярная.
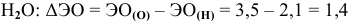 — связь ковалентная полярная
— связь ковалентная полярная
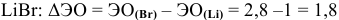 — связь ионная.
— связь ионная.
Задача № 6. Укажите из перечисленных молекул: 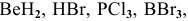
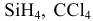 — молекулы с гибридизацией. Какого типа эта гибридизация?
— молекулы с гибридизацией. Какого типа эта гибридизация?
Пример 45
Какой тип гибридизации в молекуле 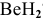 ?
?
Решение:
В невозбужденном состоянии электронная конфигурация внешнего электронного уровня следующая: 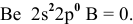
В возбужденном состоянии 
Образование двух идентичных связей с 2 атомами водорода требует гибридизации типа 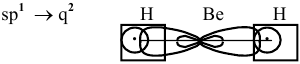
Задача № 7. Какова форма следующих молекул:
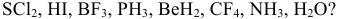
Пример 46
Какова форма молекулы 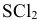 ?
?
Решение:
Электронные конфигурации последних электронных слоев S и 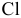 следующие:
следующие:
Оба неспаренных р-электрона серы участвуют в образовании связей с двумя атомами хлора, обладающими по одному неспаренному р-электрону, образуя угловую молекулу 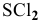 с углом
с углом 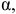 несколько большим 90°.
несколько большим 90°.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

